Inscription / Connexion Nouveau Sujet
cohésion d'un cristal ionique
Bonjour, j'ai un dm à rendre lundi, et je ne comprend absolument rien.
Voici déjà un exercice :
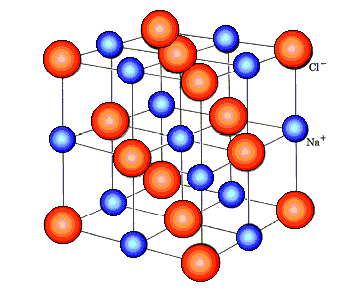
dans un cristal le chlorure de sodium NaCl, on appelle note a le paramètre de maille. Dans le cas du cristal de chlorure de sodium a = 564 pm. La plus petite distance entre deux ions Cl- ou deux ions Na+ est : dr = a/(racine carré de 2) . La plus petite distance entre un ion Cl- et un ion Na+ est da= a/2
a) déterminer la force qui s'exerce entre un ion Na+ et un ion Cl-
b) Déterminer la force qui s'exerce entre deux ions Na+ ou entre deux ions Cl-.
c) Comparer ces deux forces et conclure quant à la stabilité du cristal ionique.
Si quelqu'un pouvait m'aider ça serait gentil parce que je suis totalement perdu, cet exercice n'est pas dans mon dm c'est un exercice que je dois faire à part mais c'est pour voir comment on fait pour pouvoir faire mon dm seule.
Bonjour, alors pour la première question j'avais pensée à calculer la force électrique en faisant :
Fel = k * |qa*qb| / d² qui ferait :
Fel = 9.10^9 * (-1,6.10^-19 * 1,6.10^-19) / (564.10^-12)²
est-ce possible ?
Il faut mieux expliquer ce que tu fais :
Na+ a une charge +e
Cl- a une charge -e
De plus la distance entre un ion Na+ et Cl- est dr
Donc F = K.(|-e|.|e|)/dr^2
Ton calcul est presque correct sauf qu'une valeur absolue est toujours positive !
Alors comment je peux faire puisque c'est moins ?
Donc j'ai compris un petit quelque chose quand même alors 
aussi-non pour la b j'ai trouver pour Na+ : Fel = k * (|e|²) / dr² = 9,10^9 * (1,6*10^9)² / (564*10^-12)² = 7,24.
Je ne me suis pas trompé ?
Et pour la comparaison je pense que ça ira et de toute façon il faut que j'attende le bon résultat du premier .
Merci beaucoup
Alors comment je peux faire puisque c'est moins ?
TU AS DES VALEURS ABSOLUES !
|-4|=|4|=4 par exemple ...
b) Déterminer la force qui s'exerce entre deux ions Na+ ou entre deux ions Cl-.
F = K.e2/(d')2 (cette fois-ci la distance change)
Ah oui c'est vrai, alors au premier la distance n'est pas correct, je devais faire 564*10^-12 / (racine carré)2
et pour le b) alors la distance est : 564*10^-12 / 2
je devais faire 564*10^-12 / (racine carré)2
ne fais pas des calculs intermédiaires, pose l'application numérique intégralement
Je devais faire au premier :
Fel = k * |qa*qb| / d² qui ferait :
Fel = 9.10^9 * (1,6.10^-19)² / [(564.10^-12) / 2]²
Salut a tous!
Mon intitulé moi est :
le cristal de sel Na+Cl- est definit par une arête d'un cube a= 564 pm
Interresont nous aux force qui s'exerce sur un ion chlorure A positionné sur l'arête du cristal par la presence de ces trois proches voisins B,C,D.
Calculer la valeur des forces électrique exercés par les cations Na+ sur le chlorure A
C'est à peu pres la meme chose sauf que je ne comprend pas pourquoi vous divisé la distance par deux ?
On n'a pas divisé la force par deux (déjà on parle de norme ici).
La distance entre Na+ et Cl- est d = a/2
F = Ke^2/d^2
C'est une valeur donnée par l'énoncé. Normalement on peut le retrouver avec la cristallographie mais c'est hors programme pour les premières.
Si tu veux, pour être succinct, NaCl est un cube d'arête a (le paramètre de la maille) :
tu vois bien que le plus courte distance entre Na+ (en bleu) et Cl- (en rouge) est la moitié de l'arête soit a/2

Et pour la dernière question : c) Comparer ces deux forces et conclure quant à la stabilité du cristal ionique.
J'ai conclut que c'était la force qui s'exerce entre un ion Cl- et un ion Na+ qui l'emporte.
mais pour conclure quant à la stabilité du cristal ionique, je ne vois pas ce qu'il faut dire ?
Si la force entre deux entités identiques l'emportait (Na+/na+ ou Cl-/Cl-) le cristal se dissocierait car il y a répulsion pour deux charges identiques.
Or ici la force Na+/Cl- ou Cl-/Na+ l'emporte (et les charges s'attirent).
Cela assure donc une stabilité au cristal



