Inscription / Connexion Nouveau Sujet
Exercice de Chimie Lycée
Bonjour , est ce que quelqu'un peut m'aider s'il vous plaît pour cette exercice
Dans le laboratoire d'un lycée, on dispose d'un flacon d'une solution d'acide chlorhydrique
concentrée où est notée sur l'étiquette l'indication suivante:
33 % minimum en masse d'acide chlorhydrique
On appellera cette solution S0 . On veut connaître la concentration molaire C0 de cette solution.
Première étape : On dilue 1 000 fois la solution S0. On obtient alors une solution S1 de
concentration C1.
Deuxième étape : On prélève précisément un volume V1 = 100,0 mL de solution S1
On dose par conductimétrie la solution S1 par une solution titrante d'hydroxyde de sodium de
concentration CB = 1,00.10-1 mol.L-1 . La représentation graphique de la conductance de la solution en
fonction du volume V de solution titrante versé est donnée dans l'annexe, document 1.
3°/Déterminer graphiquement, sur le document 1, le volume versé Véq à l'équivalence
4°/Intérpréter l'allure de la courbe avant et après l'équivalence .
Données : λH3O+ = 349,8.10-4 S.m².mol-1 ; λNa+= 50,1.10-4 S.m².mol-1 ; λCl- = 76,3.10-4 S.m².mol-1. λHO- = 198,6.10-4 S.m².mol-1 .
5°/ A l'aide d'un tableau d'avancement, déterminer la quantité de matière initiale d'ions oxonium OH- dans le volume V1 de solution S1
6°/ Calculer la concentration molaire C1 de la solution d'acide chlorydrique diluées S1 .
Bonjour à tous les deux,
AlexisLouisArman >> Pour apprendre à insérer une image, une figure, un schéma, un graphique, un tableau (pas un énoncé !) clique sur la maison 
![]() [lien]
[lien]

Merci , donc voici les deux graphique et le sujet ci dessous
Dans le laboratoire d'un lycée, on dispose d'un flacon d'une solution d'acide chlorhydrique
concentrée où est notée sur l'étiquette l'indication suivante:
33 % minimum en masse d'acide chlorhydrique
On appellera cette solution S0 . On veut connaître la concentration molaire C0 de cette solution.
Première étape : On dilue 1 000 fois la solution S0. On obtient alors une solution S1 de
concentration C1.
Deuxième étape : On prélève précisément un volume V1 = 100,0 mL de solution S1
On dose par conductimétrie la solution S1 par une solution titrante d'hydroxyde de sodium de
concentration CB = 1,00.10-1 mol.L-1 . La représentation graphique de la conductance de la solution en
fonction du volume V de solution titrante versé est donnée dans l'annexe, document 1.
3°/Déterminer graphiquement, sur le document 1, le volume versé Véq à l'équivalence
4°/Intérpréter l'allure de la courbe avant et après l'équivalence .
Données : λH3O+ = 349,8.10-4 S.m².mol-1 ; λNa+= 50,1.10-4 S.m².mol-1 ; λCl- = 76,3.10-4 S.m².mol-1. λHO- = 198,6.10-4 S.m².mol-1 .
5°/ A l'aide d'un tableau d'avancement, déterminer la quantité de matière initiale d'ions oxonium OH- dans le volume V1 de solution S1
6°/ Calculer la concentration molaire C1 de la solution d'acide chlorydrique diluées S1 .
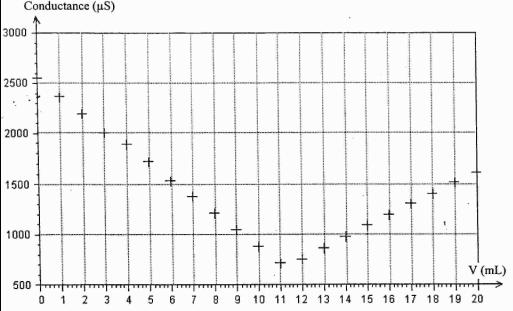
3) le volume versé à l'équivalence est de 11 ml
4) simple
5) NaOH = Na+ + OH-
[NaOH]= [OH-] = Cb . V1
pour le 3 Kaela il n'y a pas assez de détail donc il ne peut pas comprendre comme ça .
pour le 4 je ne saurais pas te dire c'est un peu difficile
sinon le 5 ça me parait bon et le 6 pareil que le 4
salut:
3)
graphiquement, sur le document 1, le volume versé Véq à l'équivalence est VBe=11mL
4) la conductance étant proportionnelle à la conductivité de la solution.
*avant l'équivalence sa diminution est due à la dimintion de la concentration des ions H3O+ ds le mélange , car la réaction qui se produit durant le titrage est :
H3O+ + HO- -> 2H2O
au fure et à mesure que le titrage se déroule les ions oxonium H3O+ se consomment.
au point d'équivalence ,tous les ions H3O+ contenues ds le volume VA ont pratiquement disparu .la faible conductance de la solution de l'ordre de 700 S est due au ions Na+ et Cl- qui ont une faible conductivité molaire ionique par rapport aux ions H3O+ et HO-.
S est due au ions Na+ et Cl- qui ont une faible conductivité molaire ionique par rapport aux ions H3O+ et HO-.
Après l'équivalence l'augmentation de la conductance de la solution est due à l'excès des ions HO- apportés par l'addition de soude .
En comparant les conductivité m.ionique on constate bien que celle de Na+ et Cl- sont très faibles devant celle de H3O+ et HO-.
Données : λH3O+ = 349,8.10-4 S.m².mol-1 ; λNa+= 50,1.10-4 S.m².mol-1 ; λCl- = 76,3.10-4 S.m².mol-1. λHO- = 198,6.10-4 S.m².mol-1 .
5°/ A l'aide d'un tableau d'avancement, déterminons la quantité de matière initiale d'ions oxonium H3O+ dans le volume V1 de solution S1.
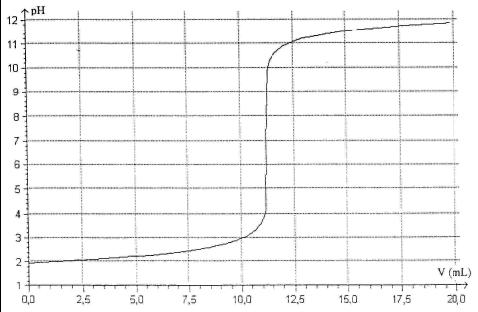
d'après la courbe 2 , on a pH 2 avant le comencement du dosage.
2 avant le comencement du dosage.
=> [H3O+] 10-2 mol/L
10-2 mol/L
H3O+ + HO- -> 2H2O
CA.VA CBVB 0
CA.VA-x CBVB-x 2x
pour x=0 on a : n(H3O+)=CA.VA=[H3O+].VA=10-2.VA=10-2.0,1=10-3 mol
6°/CA.VA=CB.VBe
=>


