Inscription / Connexion Nouveau Sujet
Variation d'enthalpie
Bonjour, je suis face à un exercice de thermodynamique que je peine à résoudre :
On considère la combustion d'un volume V= 371m3 de gaz de schiste réalisée avec un excès de dioxygène sous 1 bar à 298K. Cette combustion est totale. On assimile le gaz de schiste à du méthane pur. On considère que le système où se produit la combustion est idéal
- Calculer la variation d'enthalpie  Hi
Hi f entre l'état initial et l'état final de la combustion.
f entre l'état initial et l'état final de la combustion.
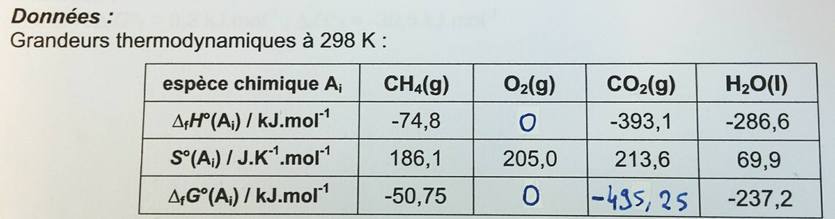
Données :
 cHo(CH4(g),298K) = -891,5 kJ.mol-1
cHo(CH4(g),298K) = -891,5 kJ.mol-1
CH4(g) vérifie le modèle du gaz parfait
1 bar = 105 Pa
R = 8,31 J.K-1.mol-1
Mon raisonnement :
 Hi
Hi f = ξf.
f = ξf. rH
rH
ξf = n0(RL)/ (RL) RL :Réactif limitant et
(RL) RL :Réactif limitant et  son nombre stochimétrique
son nombre stochimétrique
Le réactif limitant est le méthane CH4 donc :
ξf = n0(CH4)/ (CH4)
(CH4)
Pour trouver n0(CH4) j'utilise la loi de gaz parfait pV = nRT où n = PV/RT
On a donc : n(CH4)= 105x371/8,31x298
n(CH4)= 14 981,5 mol (ce qui me parait ahurissant comme quantité de matière)
On a donc ξf = 14 981,5/1
ξf = 14 081,5 mol
Je possède l'avancement final de CH4, il me faut maintenant le  rH, mais comment le trouver ? Est-ce la valeur de
rH, mais comment le trouver ? Est-ce la valeur de  cHo(CH4(g),298K) ?
cHo(CH4(g),298K) ?
Merci pour votre aide je suis complètement bloqué
Bonjour,
tu as sûrement étudié l'expression de l'enthalpie standard de réaction en fonction des coefficients stchiométriques et des enthalpies standard de formation. On te fourni celle du méthane. Que vaut l'enthalpie standard de formation d'un corps simple???
Remarque complémentaire : les enthalpies standard de formation de H20 et de CO2 n'étant pas fournies, la valeur fournie concernant CH4 est sans doute simplement l'enthalpie standard de combustion pour une mole de méthane.
Il faut utiliser des notations plus précises :
 rH° pour une enthalpie standard de réaction ;
rH° pour une enthalpie standard de réaction ;
 fH° pour une enthalpie standard de formation.
fH° pour une enthalpie standard de formation.
Tout est clair maintenant !
équation bilan : CH4 + 2O2 = CO2 + 2H2O
Si tu utilises la formule de ton cours :
en utilisant les tables thermodynamiques que tu viens de poster, on obtient : -891,5kJ/mol ;
c'est donc mon hypothèse postée le 23-10-15 à 13:22 qui est la bonne.
Donc pour calculer la variation d'enthalpie  Hi
Hi f entre l'état initial et l'état final de la combustion je dois donc utiliser cette relation ? :
f entre l'état initial et l'état final de la combustion je dois donc utiliser cette relation ? :
 Hi
Hi f = ξf.
f = ξf. rH°
rH°
 Hi
Hi f = 14 981,5 x(-891,5)
f = 14 981,5 x(-891,5)
= -13356007,25 kJ.mol-1
Je suis assez certain d'être sur la mauvaise voie..
Donc pour calculer la variation d'enthalpie
 Hi
Hi f entre l'état initial et l'état final de la combustion je dois donc utiliser cette relation ? :
f entre l'état initial et l'état final de la combustion je dois donc utiliser cette relation ? :
 Hi
Hi f = ξf.
f = ξf. rH°
rH°
 Hi
Hi f = 14 981,5 x(-891,5)
f = 14 981,5 x(-891,5)
= -13356007,25 kJ.mol-1
Je suis assez certain d'être sur la mauvaise voie..
Il ne faut pas être pessimiste comme cela ! Ton raisonnement est correct ! Juste une remarque à propos des applications numériques : utilise de préférence les puissances de dix en donnant autant de chiffres significatifs que la donnée la moins précise utilisée en comporte (sans prendre en compte P° = 1bar qui est une donnée ici imposée par les conditions standard). Les données sont fournies avec 3 ou 4 chiffres significatifs : tu donnes donc ton résultat avec 3 chiffres :
 H=1,33.1010J/mol ou 1,33.107kJ/mol
H=1,33.1010J/mol ou 1,33.107kJ/molD'accord merci beaucoup pour votre aide !
Mais finalement si pour calculer  Hi
Hi f il nous faut juste ξ et le
f il nous faut juste ξ et le  rH° de la réaction, à quoi nous sert le
rH° de la réaction, à quoi nous sert le  cH°(CH4(g),298K) = -891,5 kJ.mol-1 disponible dans les données ?
cH°(CH4(g),298K) = -891,5 kJ.mol-1 disponible dans les données ?
Ton exercice est peut-être un copier-coller de deux exercices différents... Dans le premier, on ne fournissait pas les tables thermodynamiques mais on fournissait l'enthalpie standard de la réaction de combustion (cela expliquerait l'indice c à la place du classique r)
Évidemment, j'imagine que l'exercice se poursuit par des questions sur les autres grandeurs de réaction...