Inscription / Connexion Nouveau Sujet
un petit exercice de précipitaion
Bonjour
en cherchant une solution a cet exercice,j'ai trouvé deux propositions différentes a propos de la 2eme question.
voila l'exercice:
Par addition d'une base forte dans une solution d'ions Al3+, il se forme tout d'abord
un précipité de Al(OH)3 qui se redissous dans un excès d'ions hydroxydes (OH−)
en formant le complexe Al(OH)−4
1. Calculer les constantes des réactions suivantes :
Al3+ + 3OH−⇋Al(OH)3
Al(OH)3 + OH−⇋Al(OH)-4
On donne : pKs(Al(OH)3) = 32 ; pβ4 = - 35
2. Quelles sont les valeurs de pH de début et de fin de précipitation lorsque le
pH d'une solution contenant initialement 10−3 moℓ.ℓ−1 ?
3. En déduire le domaine de prédominance des ions Al3+ et Al(OH)-4 ainsi que
le domaine d'existence du précipité Al(OH)3
svp aider moi (la 2eme question)
Bonjour
Et si tu indiquais ce que tu as été capable de faire en précisant ce qui te bloques ensuite ? Il sera plus facile de t'aider ensuite.
Début de précipitation : tu écris que l'équilibre de précipitation correspondant à
Al3+ + 3OH−⇋Al(OH)3 existe donc :
mais la quantité de précipité formé est totalement négligeable de sorte que : [Al3+] c=10-3mol/L
c=10-3mol/L
la suite est facile !
Fin de précipitation :
même raisonnement en considérant l'équilibre entre le précipité et l'ion aluminate.
merciiiiiiiiiiii vanoise
donc l'astuce est que le précipité est négligeable,ce qui donne que la concentration de AL3+ reste la même.
mais comment on peut savoir que le précipité est négligeable ou non
Lis bien l'énoncé : il est question de déterminer le pH de début et le pH de fin de précipité.
Imagine une solution de chlorure d'aluminium contenant c mol/L d'ions aluminium. Tu y ajoutes progressivement des cristaux de soude de façon à augmenter lentement le pH sans variation sensible de volume. Le pH d'apparition du précipité est bien le pH limite où le précipité existe mais en quantité négligeable. Comme ce pH n'est pas suffisamment élevée pour que des ions aluminate apparaissent de façon non négligeable, tu obtiens la situation que je t'ai décrite.
Remarque : une fois ce pH obtenu, tu peux, pour plus de rigueur, vérifier que pour cette valeur de pH : [Al3+] >> [Al(OH)4-]
ks(AL(OH)3)=10-33 signifie que si le précipité existe,alors il existe avec une quantité négligeable (est ce que j'ai raison?  )
)
alors il existe avec une quantité négligeable
Pas nécessairement. La relation :
est valide tant que le précipité existe, quelle que soit la quantité de ce solide. Je reprends le "film" de l'augmentation de pH à volume fixe décrit hier à 12h20.
Tant que le pH reste faible :
Dès que le pH atteint une valeur telle que :
le précipité apparaît. Si on continue à ajouter des ions hydroxyde, la quantité de précipité augmente. La réaction Al3+ + 3OH−⇋Al(OH)3 se déroute dans le sens direct jusqu'à devenir quasi totale. Ainsi on a maintenant :
Si on continue à ajouter des ions hydroxyde une nouvelle réaction intervient et fait disparaître le précipité : Al(OH)3 + OH−⇋Al(OH)4 -. Le pH limite de disparition du précipité correspond au cas où l'équilibre précédent existe avec une quantité restante de précipité négligeable. Dans ce cas :
où K désigne la constante d'équilibre que tu as calculée à la première question.
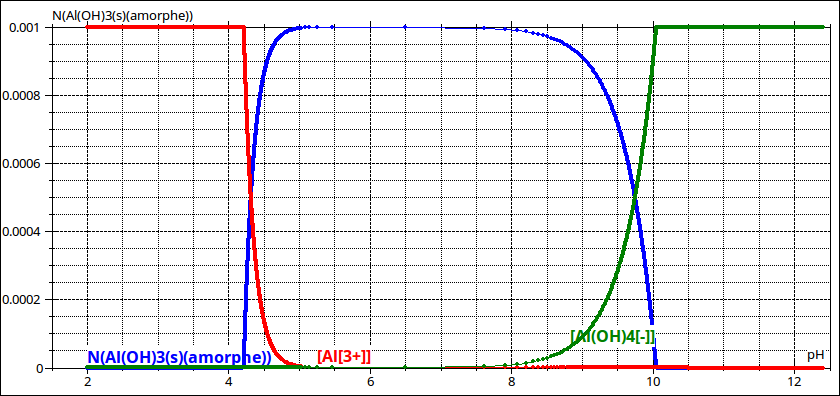
Pour t'aider voici une simulation représentant les variations en fonction du pH de :
- en bleu : la quantité de précipité pour un volume de 1L (évidemment : la notion de concentration d'un solide n'a pas de sens !)
- en rouge : la concentration en ions aluminium
- en vert : la concentration en ions aluminates