Inscription / Connexion Nouveau Sujet
Type d'hybridation
Bonjour,
Je voudrais qu'on m'aide à comprendre comment déterminer la nature de l'hybridation d'un atome. J'ai lu mes cours et de multiples explications sur le net mais je reste toujours dans la même interrogation.
J'ai ceux QCM à résoudre:
Soit CH2=C=CHCl. Quelle(s) est(sont) la(les) proposition(s) exacte(s)?
A. Tous les atomes sont hybridés sp2
B. Tous les atomes sont situés dans un même plan
C. L'atome de chlore est hybridé sp3
D. La molécule comprend 5 liaisons "sigma" et 2 liaisons "pi"
E. Un seul carbone est hybridé sp
=> Les bonnes réponses sont C et E.
Mais, sans correction détaillé, je n'avance pas dans ma recherche d'explication.
Pour commencer, j'ai représenté la molécule dans le modèle de Lewis.
=> Je peut éliminer la réponse D comme je constate qu'il y a 4 liaisons "sigma" et 2 liaisons "pi".
=> Je sais aussi que si tous les atomes sont hybridés sp2 alors ils sont situés dans le même plan. Donc, A vrai <=> B vrai.
Donc, pour affirmer ou infirmer les réponses A, B, C et E; je suis preneuses de vos explications.
Merci d'avance
Bonjour anonymouseuse :
A). juste .
B). juste .
C). juste .
D). non , 5 liaisons sigma C-H ; 1 liaison sigma C-Cl et 2 liaisons pi . ( CH2=C=CHCl , total 6 liaisons sigma ) .
E). juste .
Bonnes salutations .
Bonjour,
certaines questions sont plus faciles que d'autres.
Pour connaître l'état d'hybridation d'un atome, il suffit de connaître sa géométrie.
Tétraédrique --> Hybridé sp3
trigonal plan --> Hybridé sp2
Linéaire --> Hybridé sp
Il faut se référer à la théorie VSEPR pour connaître la géométrie de l'atome et son environnement.
A. -> Faux. L'atome de carbone central a seulement 2 voisins et aucun doublet non-liant ==> géométrie linéaire, hybridé sp
C -> Vrai. L'atome de Cl a 1 atome voisin et 3 doublets non-liants ==> géométrie tétraédrique, hybridé sp3
E -> Vrai.
Pour la question D. je rejoins molecule10 sauf qu'il y a 2 liaisons  C-C et 3 C-H.
C-C et 3 C-H.
Le question B est la plus difficile. Une fois connu l'état d'hybridation des atomes en présence et la nature des orbitales moléculaires, il faut que tu fasses un schéma de toutes les orbitales moléculaires concernées. En faisant ça tu t'apercevras qu'une seule configuration géométrique est possible, et que tous les atomes n'y sont pas dans le même plan.
il est essentiel que tu fasses toi-même ce schéma pour bien comprendre ce qu'il se passe, mais si tu y arrives vraiment pas je t'enverrai un petit schéma qui t'aidera peut-être.
En espérant t'avoir été utile.
Bonjour,
Merci beaucoup Moustikipic!
=> Je voudrais bien le schéma pour la question B .
=> Pour la D, tu dit qu'il y a " 2 liaisons C-C et 3 C-H".
Pour les liaisons "pi" c'est que entre C-C et "sigma" entre C-H?
Merci de ton aide
J'oubliais,
mon affirmation "si tous les atomes sont hybridés sp2 alors ils sont situés dans le même plan" est t-elle exacte?
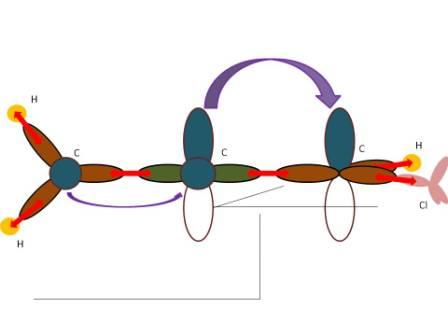
Voici le schéma dont je te parlais, je ne peux pas faire mieux.
Légende :
orbitales marron : sp2
orbitales bleues et blanches : p
orbitales jaunes : s
orbitales roses : sp3
Les flèches rouges sont des liaisons  et les violettes des liaisons
et les violettes des liaisons  .
.
Je te recommande tout de même de refaire ce schéma pour te le représenter en 3 dimensions :
Les atomes d'hydrogène à gauche et les atomes de C sont dans le plan de la feuille. Seulement il est impossible de faire contenir les atomes H et Cl de droite dans ce même plan, ils sont contenus dans un plan perpendiculaire !
Tu peux faire le même schéma avec des atomes (peu importe qu'ils soient C, N...) hybridés sp2, tu trouveras qu'ils sont situés dans un même plan. C'est notamment le cas dans les molécules aromatiques !
Je vais essayer d'appliquer le schéma à d'autres atomes. Merci
Pourrait-tu me répondre pour les 2 autres questions, STP:
=> Pour la D, tu dit qu'il y a " 2 liaisons C-C et 3 C-H".
Pour les liaisons "pi" c'est que entre C-C et "sigma" entre C-H?
=> "si tous les atomes sont hybridés sp2 alors ils sont situés dans le même plan" est t-elle exacte?


