Inscription / Connexion Nouveau Sujet
Travaux des forces de pression
Bonjour,
Voila, les exercices précédents que j'ai effectué en cours sur le diagramme de CLAPEYRON (gaz, pression, volume..)ont été pour moi une facilité sauf celui qui va suivre:
Dans un état 1 une masse donnée d'un gaz parfait occupe le volume de V1=2L. La pression est P1=10^5N/m².
1) On amène ce gaz dans un état 1', à pression constante. V1'=3L. Evaluer le travail des forces de pression.
2) Le gaz est amené de 1' dans un état 2 caractérisé par V2=5L et P2=4.10^4 N/m². On suppose qu'entre 1' et 2 le diagramme est une droite. Calculer le travail des forces de pression quand le gaz est amené de l'état 1 à l'état 2 par ces deux transformations.
3) A température constante on amène le gaz 1 à un état 2' caractérisé par P2=4.10^4N/m²
a) Calculer le volume V2, du gaz. Que peut-on dire des états 2 et 2'?
b) Calculer le travail effectué par les forces de pression au cours de la transformation.
4) Comparer les deux valeurs du travail ainsi obtenues lors du passage du gaz de 1 en 2. Conclusion.
Merci pour votre aide
bonsoir,
1)  W = -P1 dV donc W = -P1
W = -P1 dV donc W = -P1  V
V
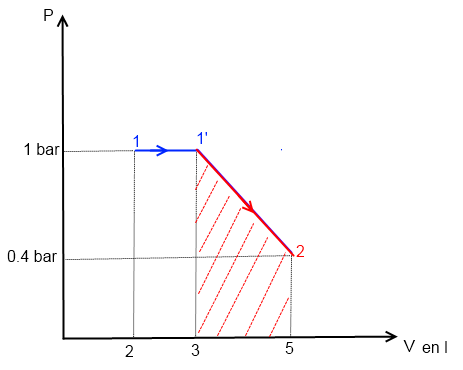
2) le plus simple est d'utiliser l'interprétation graphique du travail des forces de pression dans un diagr. de Clapeyron (cf. dessin)
le travail W1'->2 correspond à l'aire hachurée en rouge située sous la droite représentant la transformation 1'->2
affectée d'un signe - (car c'est une détente)
3) si on suppose la transformation quasi-statique on a:  W = -P dV avec PV=nRt donc P = nRT/V
W = -P dV avec PV=nRt donc P = nRT/V
donc  W = -nRT dV/V et comme T=cste cela s'intègre bien
W = -nRT dV/V et comme T=cste cela s'intègre bien
sauf erreur