Inscription / Connexion Nouveau Sujet
TP diagramme E-pH du fer
Bonjour,
J'ai un TP à préparer pour la semaine prochaine. Il s'agit de construire la partie du diagramme E-pH du fer relative aux degrés d'oxydation +II et +III.
Manipulation :
Dans un bécher, introduire 100,0 mL d'une solution contenant du sulfate de fer (II) à 1,00.10-2mol/L, du sulfate de fer (III) à 1,00.10-2mol/L et de l'acide sulfurique à 1,00.10-1mol/L
Faire un dosage de cette solution par de la soude de concentration c=1,00mol/L
Données : E°(Fe3+/Fe2+)=0,77V
pKs(Fe(OH)3)=37 ; pKs(Fe(OH)2)=15
La dernière question du TP me pose vraiment problème :
Afin de retrouver expérimentalement la valeur du potentiel standard du couple Fe3+/Fe2+, il est nécessaire de considérer la complexation des ions Fe3+ et Fe2+, par les ions sulfates présents en solution selon les réactions :
Fe3+ + SO42-=FeSO4+ Kf1=104,1
Fe2+ + SO42-=FeSO4 Kf2=102,6
En supposant que tous les ions fer sont ici sous forme complexés, déterminer à partir du diagramme E-pH expérimental le potentiel standard du couple Fe3+/Fe2+.
Voici ce que j'ai fait :
mais après je ne vois pas comment faire pour déterminer [FeSO4+] et [FeSO[sub]4].
Merci d'avance pour votre aide !
La ligne frontière expérimentale correspond à l'égalité des concentration des ions complexés. Elle correspond me semble-t-il à sensiblement 0,68V.
La ligne frontière obtenue en absence d'ions sulfate créant une complexation, correspond à [Fe3+]=[Fe2+] et donc E=E° de ce couple. Une soustraction "membre à membre des deux relations que tu as écrites devrait te conduire à un potentiel plus élevé de , ce qui conduit à un potentiel standard E° voisin de 0,77V.
Bonsoir,
Je ne comprends pas quelles sont les relations dont je dois faire une soustraction membre à membre....Je sais que sur la ligne horizontale on a E=E° mais je ne vois pas comment on en déduit une simplification de et
J'ai aussi une autre question concernant la 1ere partie du TP dont voici l'énoncé :
On désire tracer le diagramme E-pH de l'argent, en tenant compte des trois espèces Ag(s), Ag+(aq) et Ag(OH)(s).
Dans une fiole jaugée de 100mL, introduire 10,0mL d'une solution de nitrate d'argent (Ag+,NO3-) à 0,100mol/L, 10,0mL d'une solution d'acide éthanoïque à 0,100mol/L puis compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter puis verser cette solution dans un bécher de 250mL.
Remplir la burette avec une solution de soude de concentration c=1,00mol/L et réaliser le dosage.
J'ai essayé de mesurer le volume équivalent pour voir à quoi je devrai m'attendre et j'ai trouvé un truc complètement absurde :
A l'équivalence on a : nCH3COOH=nHO- d'où Véq=(0,100*10,0.10-3)/1,00=1,00mL ce qui me paraît faux.......
Comme tu l'as bien compris, la frontière horizontale du diagramme de Pourbaix a pour ordonnée E°.
A cause de la complexation, la frontière apparente (celle mesurée) a pour frontière horizontale le potentiel correspondant à l'égalité des concentrations en ions complexées :
Cela donne bien le décalage dont je t'ai parlé.
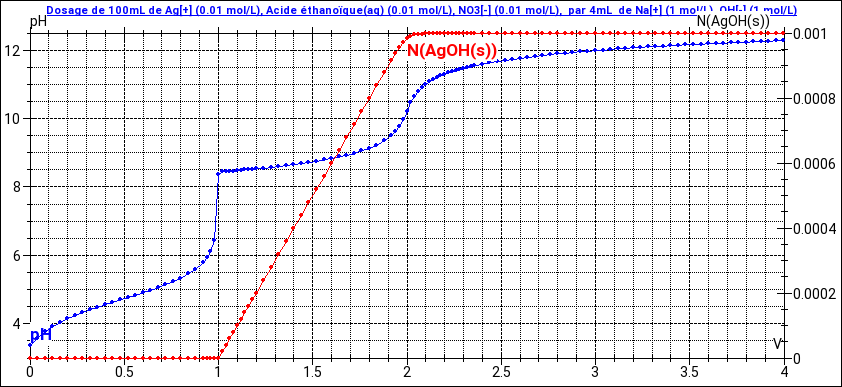
Pour le titrage, le problème est très proche d'un nous avons parlé il y a peu. Le titrage commence par le dosage de l'acide éthanoïque par la soude mais, dès la fin de ce dosage, le pH devient suffisamment basique pour que démarre la précipitation des ions argent. Tu obtiens donc deux équivalences, une à 1mL de soude, l'autre à 2mL de soude ajoutée. (voir document).
Pour le premier truc qui me pose problème :
En fait ce qui me perturbe c'est que la frontière qu'on va mesurer expérimentalement correspond si j'ai bien compris à celle du couple FeSO4+/FeSO4 donc à cette frontière on a Emesuré=E°FeSO4+/FeSO4+0,06log(Kf2/Kf1) car [FeSO4+]=[FeSO4] mais pourquoi est-ce qu'à cette même frontière on aurait aussi [Fe3+]=[Fe2+] ? Normalement c'est "une égalité" par frontière non ? Du coup pourquoi on aurait à la fois [Fe3+]=[Fe2+] et [FeSO4+]=[FeSO4] ?
Pour mon 2e problème :
Du coup on a les 2 réactions suivantes qui ont lieu :
Ag++HO-=AgOH K°1=107,7
CH3COOH + HO-=CH3COO-+H2O K°2=109,2
Le problème c'est que le  pKa<4 donc logiquement on devrait avoir ces 2 réactions simultanées mais ce n'est pas le cas parce-que d'après ton graph c'est successif. Et normalement ce serait CH3COOH + HO-=CH3COO-+H2O qui aurait lieu en premier car K°2>K°1 mais ça me paraît étrange car on voit que la première équivalence correspond à la précipitation des Ag+. Ensuite j'ai un dernier soucis : ici tu me dis qu'il y a deux équivalences mais dans un autre exercice tu m'avais dit que le début de précipitation (ici à 1,00mL) ne correspondait pas à une équivalence. Du coup je pense qu'il y a des chose que je n'ai pas compris et je voudrais bien qu'on me réexplique stp.
pKa<4 donc logiquement on devrait avoir ces 2 réactions simultanées mais ce n'est pas le cas parce-que d'après ton graph c'est successif. Et normalement ce serait CH3COOH + HO-=CH3COO-+H2O qui aurait lieu en premier car K°2>K°1 mais ça me paraît étrange car on voit que la première équivalence correspond à la précipitation des Ag+. Ensuite j'ai un dernier soucis : ici tu me dis qu'il y a deux équivalences mais dans un autre exercice tu m'avais dit que le début de précipitation (ici à 1,00mL) ne correspondait pas à une équivalence. Du coup je pense qu'il y a des chose que je n'ai pas compris et je voudrais bien qu'on me réexplique stp.
Je ne suis finalement pas certain que tu ais bien compris mes messages ici :
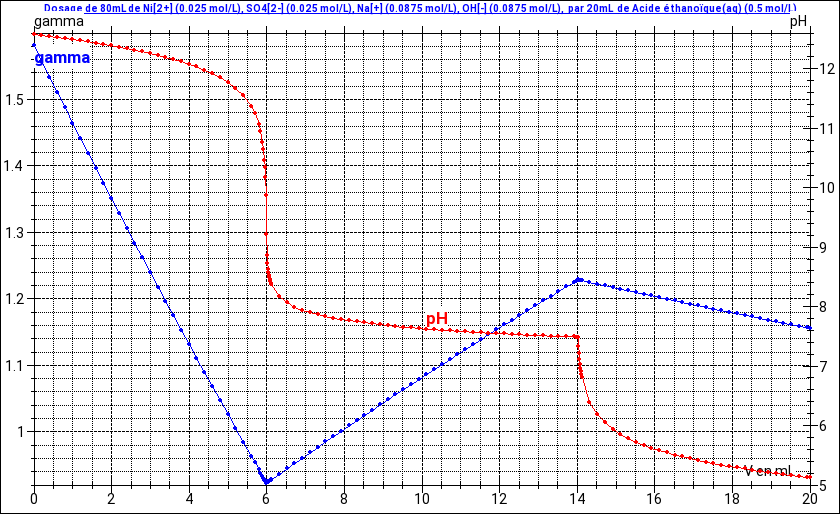
![]() titrage par précipitation des ions Ni2+
titrage par précipitation des ions Ni2+
Le rapport des constantes supérieur à 104 n'intervient pas dans ce problème. La réaction de précipitation ne peut pas avoir lieu tant que [Ag+].[HO-]<Ks ! Elle ne peut pas commencer tant que le pH reste inférieur à 8,5 environ.
Pour le premier exercice, même en présence d'ions sulfate, les ions fer(II) et fer(III) sont toujours présents même s'ils sont minoritaires. Le potentiel (évidemment unique) de la solution peut toujours s'écrire :
Le rapport des deux concentrations peut aussi s'écrire en fonction des concentrations en complexes et de leurs constantes de formation :
Certains auteurs notent :
Ce qui à mon avis est plus source de confusion qu'autre chose...
Pour le 1er problème je comprends comment on obtient mais après je ne sais pas ce qu'on mesure : c'est E°FeSO4+/FeSO4 ? Je suis un peu perdue.....
Pour le titrage : je veux bien que tu me réexpliques. En effet je pense que je n'avais pas entièrement compris ton explication précédente. En fait, j'ai compris que quand on a une allure de courbe comme ici à V=1mL ça veut dire qu'il y a précipitation mais je ne comprends pas pourquoi je trouve que le 1er volume équivalent pour CH3COOH est à 1mL car selon l'allure de la courbe il devrait plutôt être à 2mL non ? J'aimerais bien que tu prennes le temps de me reexpliquer stp.
Je n'ai pas le protocole précis de ton TP mais j'imagine que tu mesures le potentiel de la solution à l'égalité des concentrations : [FeSO4+]=[FeSO4] ; le potentiel est alors égal au potentiel standard apparent et non au potentiel standard
.
Pour le titrage, il faut bien comprendre que, tant que la solution n'est pas saturée, c'est à dire tant que
[Ag+].[HO-]<Ks,
la réaction de précipitation ne peut avoir lieu. Tout se passe alors comme s'il s'agissait uniquement de doser l'acide éthanoïque. La courbe de titrage obtenue est exactement celle que l'on obtiendrait en absence d'ions argent tant que [Ag+].[HO-]<Ks.
Cela se justifie en comparant la constante d'équilibre et le quotient de réaction.
Tu peux aussi calculer ce que serait le pH à la première équivalence en absence d'ions argent. La solution serait alors équivalente à une solution d'éthanoate de sodium de concentration cb=0,01mol/L (l'influence de la dilution est ici négligeable). Le calcul classique conduit à un pH d'environ 8,4 , ce qui correspond sensiblement au pH de saturation de la précipitation. La précipitation commence donc dès que le dosage de l'acide éthanoïque se termine et cela n'a rien à voir avec la comparaison des constantes d'équilibre, comparaison qu'il faudrait faire avec des réactions ne faisant pas intervenir de solide.
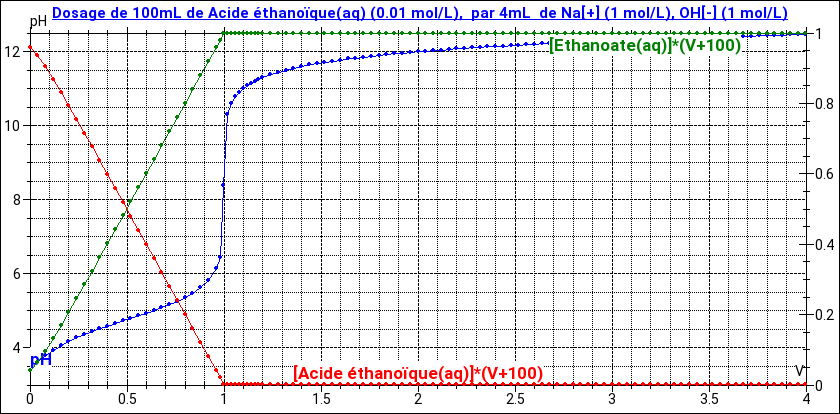
Pour illustrer mon propos, voici la courbe de titrage en supprimant le nitrate d'argent de la solution mais sans rien changer d'autre. On voit clairement que la courbe correspondant aux variations de pH est identique à celle obtenue en présence de nitrate d'argent jusqu'à la première équivalence. On voit bien aussi que la réaction de l'acide éthanoïque sur la soude peut être considérée comme quasi totale.
En rouge : l'évolution de la quantité d'acide éthanoïque ; en vert : l'évolution de la quantité d'ions éthanoate. (échelle de droite)
Je ne sais pas si tu as beaucoup de temps devant toi... A tout hasard, je te signale un sujet très proche de ce que tu étudies en ce moment. J'y joins aussi la courbe correspondant aux variations du pH.
![]() Étude conductemetrique d’un dosage
Étude conductemetrique d’un dosage
Bonsoir, merci pour tes message, j'ai fait le TP cette semaine et je pense que j'ai un peu mieux compris ce qui se passe dans ce genre de titrage. Je pense que je m'entraînerai en faisant l'exercice similaire que tu m'as mis en lien la semaine prochaine parce-que ce sera les vacances et j'aurais plus de temps.
Juste pour vérifier que j'ai compris l'essentiel : dans ce type de titrage, où on a de la précipitation et de l'acide-base :
- on ne doit pas confondre le point anguleux où il y a précipitation avec le saut de pH lié à la réaction de précipitation. Par exemple ici, le point anguleux est situé au même endroit que le 1er saut de pH lié à la relation acide-base et donc il y a précipitation des Ag+ à 1,0mL, puis on a un saut de pH lié à la réaction de précipitation à 2,0mL.
- on a pas le droit de comparer les constantes de réaction pour savoir quelle réaction a lieu en premier car on a un solide (je n'ai pas trop compris le "car" c'est-à-dire pourquoi le fait qu'on ait du solide fait qu'on n'utilise pas cette méthode). Pour savoir quelle réaction se déroule en premier : on sait qu'il va y avoir un saut de pH associé à la réaction de précipitation uniquement une fois que les Ag+ ont précipité c'est-à-dire quand [Ag+].[HO-]>Ks. Sur la courbe obtenue, sachant qu'on voit que le point anguleux est situé avant un seul saut de pH on en déduit que ce saut de pH est forcément celui lié à la précipitation des Ag+. Le saut de pH de CH3COOH est donc celui situé un peu avant le point anguleux ou disons au même endroit à peu près. Le truc qui me pose soucis, c'est que si c'est bien cela la méthode à appliquer pour comprendre quelle réaction a lieu en premier, comment ferait-on si le point anguleux était situé avant les deux sauts de pH ?
- il y a quelque chose d'autre qui m'échappe : si jamais on n'avait pas la courbe, est-ce qu'on pourrait trouver qui est dosé en premier ?
- et ma dernière question : pourquoi le fait que les Ag+ précipite "camoufle " la fin du saut de pH lié à CH3COOH ? Parce-que du coup, cela fait un peu comme si on ne voyait pas la fin du saut de pH de CH3COOH et j'aurais plutôt pensé intuitivement (mais je n'ai pas une très bonne intuition ) que la courbe aurait dû être un mix entre la fin de l'allure du saut de pH de CH3COOH et la précipitation des Ag+ alors que là la précipitation semble totalement l'emporter.
) que la courbe aurait dû être un mix entre la fin de l'allure du saut de pH de CH3COOH et la précipitation des Ag+ alors que là la précipitation semble totalement l'emporter.
(j'ai mis en gras mes questions)
pourquoi le fait qu'on ait du solide fait qu'on n'utilise pas cette méthode)
Raisonnement lorsqu'aucun solide n'est susceptible d'intervenir. Toutes les espèces intervenant dans les équilibres sont toujours présentes, même si parfois, elles deviennent ultraminoritaires ; toutes les relations entre concentrations déduites des constantes d'équilibres sont toujours valides.
La situation devient radicalement différente et plus compliquée si un solide peut se former car il y a trois cas à étudier :
1° : [Ag+].[HO-]<Ks : le solide n'existe pas ; pas d'équilibre donc entre solide et solution.
2° : [Ag+].[HO-]=Ks : équilibre entre le solide et la solution.
3° : [Ag+[/sup]].[HO[sup]-]>Ks : cette relation n'existe pas de façon permanente : supposons que l'inégalité soit vérifiée à l'instant où on mélange deux solutions : aussitôt une précipitation se produit pour se ramener au cas 2.
C'est un peu comme si, dans un circuit électrique formé de dipôles linéaires, tu introduis une diode...
- il y a quelque chose d'autre qui m'échappe : si jamais on n'avait pas la courbe, est-ce qu'on pourrait trouver qui est dosé en premier ?
L'énoncé fourni toujours la concentration c en ion argent avant l'apparition du précipité ou après sa disparition. Ces situations constituent des cas limites où le précipité existe mais en quantité totalement négligeable. On a donc alors : c.[HO-]=Ks ; cette relation permet de déterminer le pH de début de précipitation ou de fin de la dissolution d'un précipité (attention à tenir compte éventuellement du phénomène de dissolution). La connaissance de ce pH permet logiquement de répondre à ces questions.
comment ferait-on si le point anguleux était situé avant les deux sauts de pH ?
; pourquoi le fait que les Ag+ précipite "camoufle " la fin du saut de pH lié à CH3COOH ?
Dans toutes les situations étudiées, il s'agit de doser un mélange de deux espèces en solution par l'apparition de deux sauts de pH. Les deux réactions de titrages doivent êtres successives et indépendantes. Dans l'exemple ci-dessus, cela suppose un pH de début de précipitation très proche du pH de la première équivalence si bien que le saut de pH habituel semble "tronquée" par l'apparition du précipité.