Inscription / Connexion Nouveau Sujet
titrage par précipitation des ions Ni2+
Bonsoir,
J'ai une question concernant l'exercice suivant :
Une solution contient du chlorure de nickel (II) totalement soluble à la concentration C1 et de l'acide chlorydrique à la concentration Co. On prélève Vo=50,0mL de la solution que l'on titre par une solution d'hydroxyde de sodium de concentration égale à C=0,100 mol/L
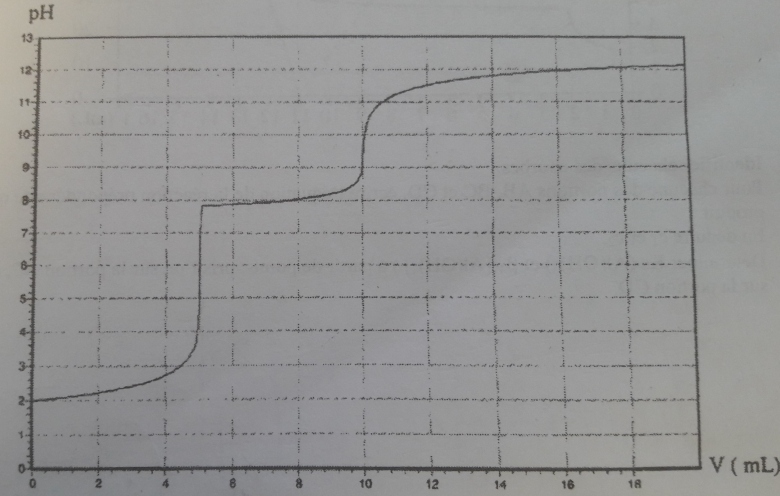
On obtient la courbe ci-dessous quand le titrage est suivi par pH-métrie: (cf image jointe)
Montrer que cette courbe permet de retrouver la valeur du produit de solubilité de l'hydroxyde de nickel.
Voici ce que j'ai fait :
A partir de 5mL, il y a précipitation de ions nickel et l'équilibre de précipitation est établi d'où Q=Ks
Ainsi [Ni2+][HO-]²=Ks
Soit
Dans la correction, on n'utilise pas la même méthode, on se sert du pH à l'équivalence qui apparaît sur la courbe pour trouver la concentration en HO-. Mais en faisant comme ci-dessus, je n'obtiens pas le même résultat que la correction et je ne comprends pas pourquoi ce que j'ai fait est faux (je ne remets pas du tout en cause la correction de mon professeur je cherche juste à savoir pourquoi mon raisonnement est mauvais).
Merci d'avance pour vos explications !
Bonjour
Ce que tu appelles "première équivalence" correspond au début de la précipitation, c'est à dire au cas limite Q=Ks avec une quantité formée de précipité négligeable. Tu as donc bien comme tu l'as écrit :
En revanche, je ne vois pas du tout le raisonnement qui te permet d'arriver à la concentration en ions hydroxyde. Cette concentration n'est pas immédiate à déterminer puisqu'elle dépend à la fois de l'autoprotolyse de l'eau (pH un peu supérieur à 7,5) et de la valeur de Ks. Impossible de la déterminer sans connaître Ks. Il faut donc s'en remettre à l'expérience et déduire [HO-] de la mesure du pH comme le fait ton corrigé.
Pour obtenir la concentration en HO-, je me suis dit qu'on avait à l'équivalence : nHO-/2=nNi2+ d'où le résultat que j'ai écrit.
Attention : le début de la précipitation ne correspond pas à une équivalence au sens habituel du terme. Les 5mL de soude ajoutées pour obtenir le début de la précipitation ont pour rôle de suffisamment augmenter le pH pour saturer la solution en hydroxyde de nickel. La première équivalence, correspondant au dosage de l'acide chlorhydrique par la soude a été obtenue à pH=7. Certes l'écart de volume est faible mais l'écart de pH est non négligeable.
Bonjour,
Je viens de refaire cet exercice et je me suis rendue compte que je n'avais pas compris ton dernier message. Dans celui-ci tu dis que la première équivalence est située à pH=7 alors que dans la correction de mon prof il y a écrit que la première équivalence est située au point anguleux soit à pH=5. Du coup je ne sais pas qui a raison et qui a tort.
Le point anguleux correspond au début de la précipitation ; selon la courbe fournie, cette précipitation correspond à pH voisin de 7,8. En toute rigueur, la précipitation commence donc après la première équivalence qui, pour un dosage acide fort - base forte correspond à pH=7.
Cependant, la courbe de titrage est quasi verticale entre pH=7 et pH=7,8 ; on peut donc considérer que l'équivalence acido basique correspond au début de la précipitation. Il faut moins d'une goutte de solution de soude pour passer d'une situation à l'autre.
D'accord merci et désolée je m'étais trompée, j'avais mal lu la correction, il y avait écrit que la 1ere équivalence était à V=5mL et non pH=5 ce qui est beaucoup plus logique.
J'ai une autre question : j'ai remarqué dans plusieurs exercices que lorsqu'on étudiait un titrage avec de la précipitation et des espèces acido-basiques, on avait très souvent la précipitation ou la dissolution qui concordait de manière très proche avec un des volumes équivalents (et souvent le premier). Est-ce qu'il y a une explication à cela ou est-ce que c'est juste du hasard ?
La première équivalence acido-basique peut être de pH assez inférieur au début de la précipitation. Cependant, l'écart de volume entre l'équivalence acido-basique et le début de précipitation est effectivement en général très faible car la première équivalence correspond à une courbe de titrage "presque" verticale.
J'ai du mal à voir la relation de cause à effet dans ta phrase :
l'écart de volume entre l'équivalence acido-basique et le début de précipitation est effectivement en général très faible car la première équivalence correspond à une courbe de titrage "presque" verticale


