Inscription / Connexion Nouveau Sujet
Titrage d'un déboucheurs par deux méthodes
Bonjours j'ai un exercice de chimie que je n'arrive pas à faire, j'ai vraiment besoin de votre aide:
Les déboucheurs pour évier sont des solutions aqueuses d'hydroxyde de sodium concentrées. Lors d'un TP,un élève titre une solution commerciale appelé S0.
Pour cela il doit diluer 200 fois la solution S0 pour obtenir une solution S,puis titrer un volume Vb=100 mL de solution S de concentration c par une solution d'acide chlorhydrique de concentration en ions oxonium Ca=2,0*10^-1 mol/L en suivant simultanément l'évolution du pH et de la conductivité de la solution.
L'équation chimique de la réaction de dosage est:
H3O+ + HO- = 2H2O
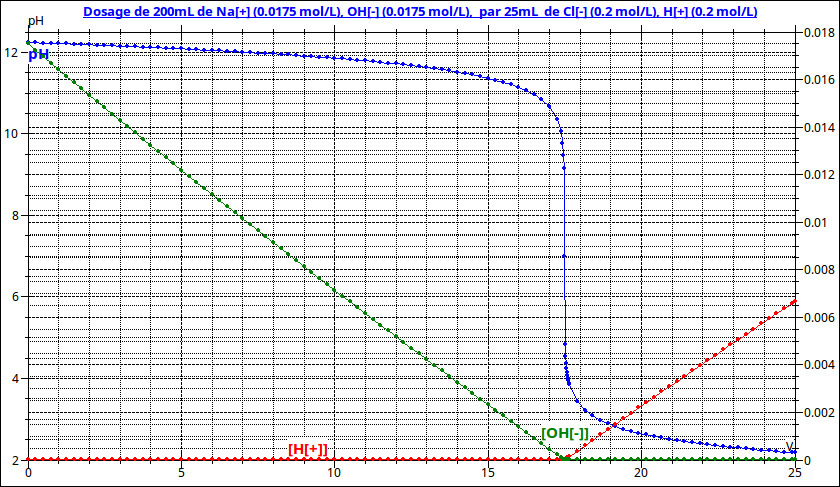
1)Identifier,en justifiant,les courbes présentées.
2)Donner pour chaque courbes,la méthode permettant de déterminer le volume Véquiv d'acide versé à l'équivalence.Donner sa valeurs;
3)Calculer la concentration c de la solution S puis en déduire la concentration c0 de la solution S0.
4)La densité du déboucheurs étant de 1,2,calculer le volume de 100g de ce déboucheur.
5)Quelle quantité de soude est contenue dans ce volume?
6)En déduire le titre massique en soude de ce déboucheurs,c'est à dire le pourcentage en masse de soude dans le déboucheurs.On donne la masse molaire de NaOH:40 g/mol.
Bonsoir,
Et si tu proposais un début de solution en exposant avec précision ce que tu ne comprends pas ? L'aide ultérieure sera plus efficace.
Remarque : la méthode des tangentes est très imprécise en général et surtout pas nécessaire ici : le titrage d'une base forte par un acide fort conduit à un pH = 7 à l'équivalence. Il suffit donc de déterminer graphiquement le volume correspondant à pH = 7 et tu constateras qu'il correspond, aux approximations de mesures près, au volume correspondant au minimum de la conductivité...
Que peut-on dire, dans le cas particulier de l'équivalence, de la quantité d'ions H3O+ fournie par l'acide et de la quantité d'ions HO- dans la solution à titrer ? De la réponse, tu peux facilement déduire une relation entre les deux concentrations et les deux volumes de solutions... Tu as forcément traité en cours quelque chose d'analogue...
Bonsoir,
Au cas où tu n'aurais pas complètement renoncé à cet exercice, voici la courbe de titrage à laquelle j'ai ajouté les deux courbes d'évolutions des concentrations : [H30+] en fonction du volume d'acide ajouté , [HO-] en fonction du volume d'acide ajouté ; Observe bien ces courbes : cela devrait t'aider...
Observe bien comment évoluent ces deux concentrations pour un volume ajouté inférieur à 17,5mL puis pour un volume ajouté supérieur à 17,5mL . Tu peux éventuellement remplir un tableau d'avancement...