Inscription / Connexion Nouveau Sujet
Titrage d'un acide fort par une dibase
Bonjour
S'il vous plait j'ai besion d'aide dans cet exo de chimie:
On titre Va=10.0 mL de HCl Ca=0.1 mol/L par du carbonate de sodium 2Na+,
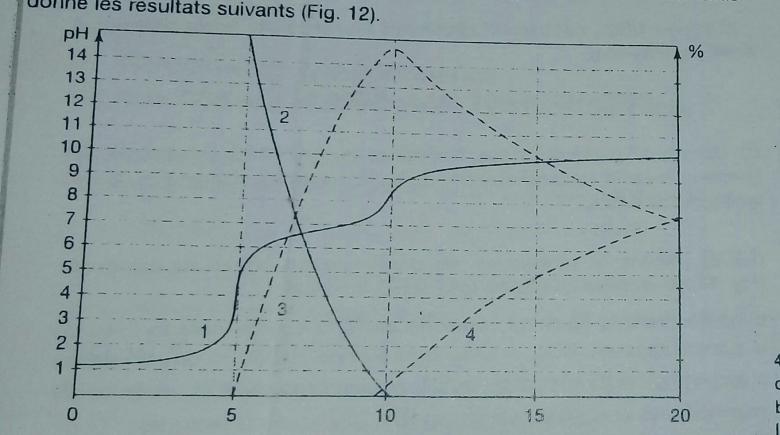
. Un logiciel de simulation nous donne les résultats suivants: (voir image)
1) Ecrire la (ou les) RP dans chaque zone de titrage après avoir identifié les courbes de distribution
Dans le corrigé de cette question j'ai trouvé que la courbe 2 est de (CO2, H2O) alors que je croyait que ça sera de HCO3- car la réaction de H3O+ et doit normalement donner HCO3- et H2O (réaction acido basique) je n'arrive pas à comprendre pourquoi ce n'est pas le cas ici..
Bonjour
Tu as raison d'une certaine façon : la RP se fait bien entre les ions oxonium et les ions carbonate pour former des ions dydrogénocarbonate. Problème : avant la première équivalence, la solution est encore nettement acide : le pH est nettement inférieure à 5,35 ; le pH correspond au domaine de prédominance de CO2 aqueux. les ions hydrogénocarbonate réagissent donc alors de façon quasi totale sur l'acide excédentaire pour produire du CO2 aqueux. Bref : avant la première équivalence, le pH est imposé par la réaction d'équation :
2H3O++CO32- = CO2(aq)+3H2O
Entre la première et la seconde équivalence, les ions carbonate ajoutés vont faire disparaitre progressivement CO2 aqueux avec formation d'ions hydrogénocarbonate :
CO2(aq)+H2O+CO32- = 2HCO3-
Après la seconde équivalence, les ions carbonates ajoutés en excès ne réagissent que de façon très partielle sur l'eau.



