Inscription / Connexion Nouveau Sujet
Titrage
Bonjour,
Je ne comprends pas comment je peux déterminer la composition d'un titre à partir de la courbe de titrage ( j'ai la concentration molaire de la base titrante 1M) et volume du composé titré 10 mL
Merci d'avance
Bonjour,
Faire un schéma simplifié de ton titrage ;
Etablir - à l'aide d'un tableau d'avancement si besoin - la relation exprimant l'équivalence de la réaction de titrage (à condition de connaître l'équation-bilan)
Déduire - à partir de la courbe - le volume versé à l'équivalence
Conclure.
Le mieux serait quand même d'avoir un énoncé complet ...

merci Gbm pour la fiche
L'énoncé est la suivante :
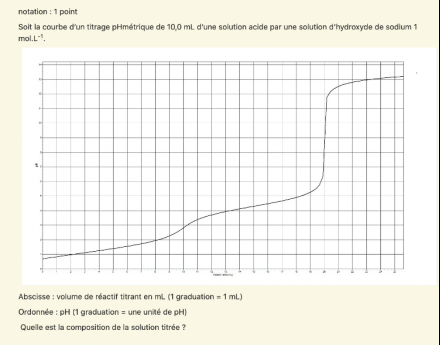
Soit la courbe. D'un titrage pH métrique de 10ml d'une solution acide par du naoh 1 molaire.
Quelle est la composition de la solution titrée:
Je ne comprends pas comment je peux déterminer la composition
Je peux déterminer s'il est fort ou faible et s'il s'agit d'un acide mais la composition je ne sais pas comment procéder
Le graphique je te l'ai joins en document
Merci d'avance
N'oublie pas ce que j'ai écrit :
Faire un schéma simplifié de ton titrage ;
Etablir - à l'aide d'un tableau d'avancement si besoin - la relation exprimant l'équivalence de la réaction de titrage (à condition de connaître l'équation-bilan)
Déduire - à partir de la courbe - le volume versé à l'équivalence
Conclure.

Bonjour,
J'ai déjà trouvé le v équivalent = 20 ml avec la règle de tangente et je sais qu'à l'équivalence le n acide = n titrant
Donc je peux trouvé la concentration du titre qui vaut 2 molaire dans ce cas mais avec ça je suis bloqué en fait
Je ne sais pas comment je peux trouver la composition de l'acide si j'ai que ça concentration
Si on considère un acide AH titré par une solution de soude :
* l'équation de la réaction du dosage est AH + HO- = A- + H2O
* l'équivalence est atteinte quand les réactifs de la réaction du dosage ont été introduits dans des proportions stoechiométriques :
n(AH) dans la solution d'acide = n(HO-) versée
<=> Ca x Va = Cb x Véq
si Ca est la concentration de la solution d'acide
Va son volume
Cb la concentration de la solution de soude
Véq la volume versé à l'équivalence.
J'ai fait ça et j'ai trouvé les valeurs écrit dans le messages plus haut
Mais je ne comprends pas en quoi ces informations vont me permettre de trouver la composition de mon acide
Vous me comprenez ?
Bonjour Selimhabibi, Bonjour gbm
Je me permet d'intervenir car la courbe de titrage fournie n'a pas du tout l'allure de la courbe correspondant au titrage d'un acide faible initialement peu dissocié par une base forte. On n'y trouve pas le léger saut de pH entre Vb=0 et Vb=0,1Vbe et surtout : ce qui a été considéré précédemment comme la demie équivalence devrait correspondre à un minimum de la courbe dérivée et non à un maximum local comme ici.
Cette courbe évoque plutôt le titrage par une base forte d'un mélange acide fort - acide faible : voir par exemple le document référencé ci-dessous, en particulier pages 6 et 7. Je ne suis pas sûr que le niveau de ce document convienne à Selimhabibi... 
![]()
Bonjour vanoise,
Tu fais bien d'intervenir car j'étais effectivement parti sur un cas beaucoup plus simple que celui que tu évoques.
Je ne sais pas si Selimhabibi va s'en sortir, déjà que je me suis vautré dans mes explications ...

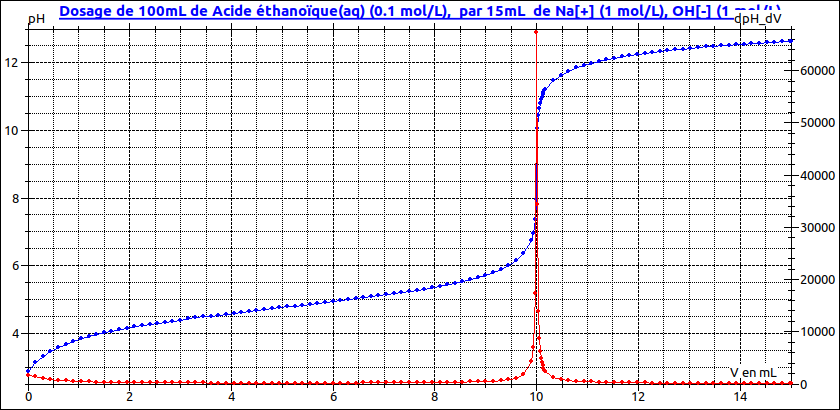
Pour illustrer mon message précédent, voici la courbe de titrage pHmétrique et sa courbe dérivée (en rouge) de l'acide éthanoïque par la soude. On y remarque l'augmentation de pH relativement forte entre 0 et 1mL et les très faibles variations de pH au voisinage de la demie équivalence qui permettent de justifier les propriétés des solutions tampons.
Bonjour vanoise,
J'ai remarqué cela aussi qu'il y'a un petit saut
Et que ce saut nous permet de conclure qu'il s'agit d'un acide diprotique
Mais dans ce cas là je ne comprends pas si je dois prendre en compte la 1 équivalence ou la deuxième ( donc ou l'on voit le 1 er saut ou le deuxième)
Merci d'avance
Un acide faible avant le titrage réagit très faiblement sur l'eau avec production d'ion oxonium H3O+. Lors du titrage par la soude, les ions hydroxyde de la soude commencent par réagir sur ces ions oxonium avant de réagir sur l'acide faible. C'est cette réaction qui est responsable de l'augmentation assez rapide du pH entre Vb=0 et Vb Vbe/10. Cela n'a rien à voir avec le fait que l'on dose un mono ou un diacide faible.
Vbe/10. Cela n'a rien à voir avec le fait que l'on dose un mono ou un diacide faible.
Pour en revenir à la courbe que tu as fournie le 15-05-21 à 16:34 :
Le premier saut de pH, aux environs de Vb=10mL correspond au dosage de l'acide fort ; tu peux donc calculer la concentration de cet acide fort.
Le volume de soude versé entre le premier et le deuxième saut de pH (encore sensiblement 10mL) correspond au dosage du mono acide faible. Ici, l'acide faible et l'acide fort semble être de sensiblement même concentration mais ta photocopie de la courbe de titrage n'est pas très nette...


