Inscription / Connexion Nouveau Sujet
Thermodynamique : gaz parfait
Bonjour à tous !
Je dispose de l'énoncé suivant :
"Dans une pièce à 20°C, à la pression de 1 bar, on veut faire décoller une montgolfière miniature en la gonflant avec de l'hélium (M(He)=4 g/mol).
On considère l'air de la pièce comme un gaz parfait constitué, en % molaire, de 80% d'azote (M(N2)=28 g/mol) et de 20% d'oxygène (M(O2)=32 g/mol)."
Je ne parviens pas à résoudre la question suivante :
"En supposant la masse de la montgolfière vide égale à 10g (son volume à vide est négligeable) et en considérant la pression à l'intérieur du ballon égale à 1 bar (on néglige la surpression due à la tension superficielle de la membrane du ballon), calculer le volume minimal d'hélium dans le ballon pour faire décoller la montgolfière."
Quelqu'un pourrait-il m'aider ? Merci 
bonjour,
tu écris le bilan des forces appliquées à la montgolfière (nacelle + gaz):
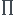 (poussée d'Archimède) - P à vide - P hélium >= 0
(poussée d'Archimède) - P à vide - P hélium >= 0
Bonjour,
Peut être pour aider au décollage:
La mongolfière, comme expliqué par Krinn est soumis à 3 forces
- le poids de l'enveloppe
- le poids de l'helium contenu à l'intérieur de l'enveloppe
- la poussée d'archimède
Qu'est ce que la poussée d'Archimède:
Si tu remplacais la mongolfière par de l'air, ce volume d'air serait soumis à son poids et cependant resterait en équilibre, c'est donc que l'air environnant ce volume exerce une pression dont la resultante est dirigée vers le haut et dont l'intensité est égale au poids de l'air à l'intérieur du volume (en découvrant cela Archmiède s'écria Eureka!)
Cette force est la même lorsque tu auras remplacé l'air par la mongolfière et aura tendance à la pousser vers le haut
Alors, on décolle?


