Inscription / Connexion Nouveau Sujet
Thermodynamique : Gaz chauffé
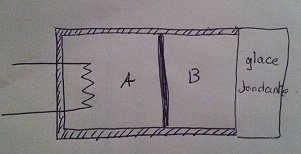
On considère un cylindre fermé, constitué de 2 compartiments A et B initialement de même volume V0= 1l. Le piston qui les sépare peut coulisser librement et sans frottement. A et B contiennent chacun n moles de gaz parfait monoatomique ( = 5/3 constant), initialement à la pression p0=105Pa et à la température T0=0°C.
= 5/3 constant), initialement à la pression p0=105Pa et à la température T0=0°C.
Le piston est calorifugé, toues les parois du cylindre, hormis la paroi verticale de droite le sont également. La paroi vertical de droite met le gaz B en contact thermique avec de la glace fondante à ka pression atmosphérique : ma température du sustème B est donc constante au cours de l'expérience : TB=T0=0°C. Le compartiment A est porté lentement à une température TA=xT0 grâce à une résistance chauffante qui lui fournit de la chaleur.
(PA, VA, TA) caractérisent l'état final du gaz A et (PB, VB, TB) celui du gaz B.
1. Quelles est la condition d'équilibre mécanique du piston?
2.Exprimer le volume VA et la pression PA en fonction des grandeurs V0, x et P0
3. Quelle est la variation d'énergie interne du gaz dans le compartiment A? Même question pour le compartiment B.
..................................
1. Pour que le piston soit à l'équilibre mécanique il faut que PA=PB
2. Je suis parti que la transformation dans le compartiment A est adiabatique réversible
en partant des lois de Laplace pour les gaz parfaits je trouve : PA=P0.x- /(1-
/(1- ) et VA=V0.x-1/(
) et VA=V0.x-1/( -1)
-1)
Mais je suis pas sûr qu'on puisse dire que la transformation est adiabatique ni réversible, si non je sais pas comment la considérer.
PS: voici un petit schéma :
bonsoir,
PA n'est sûrement pas constant.
de plus  Q est rarement nul quand on chauffe un gaz
Q est rarement nul quand on chauffe un gaz
ici en écrivant toutes les relations que tu connais tu dois pouvoir résoudre et trouver les 6 inconnues, dont PA et VA, en fct de x, Po, Vo, To
tu sais déjà que:
TB=T0
PA=PB
TA=xT0
il n'en manque plus que 3 et c'est gagné 
Effectivement, je pose :
P0V0/T0=PAVA/TA
P0V0/T0=PBVB/TB
VA+VB=2V0
après on sait que TB=T0, TA=xT0, PA=PB
on trouve que VA= (2x/(x+1)).V0 , VB=(2/(x+1)).V0 , PA=PB=((x+1)/2).V0
Pour la question 3 je trouve :
-compartiment A : gaz parfait, 1er loi de joule => dU=nCvdT donc  U=((P0V0)/(
U=((P0V0)/( -1)).(x-1)
-1)).(x-1)
-compartiment B : transformation isotherme donc dU=0 <=>  U=0
U=0



