Inscription / Connexion Nouveau Sujet
Thermodynamique/Entropie
Bonsoir chers tous. Je me laisse croire que vous vous portez à merveille. J'ai rencontré une difficulté dans la résolution de cet exercice et j'aimerais bien que vous le donniez, s'il vous plaît une pouce de mail.
Merci bien à l'avance.
On considère un cylindre indéformable à parois adiabatique divisé intérieurement en deux compartiments de volumes respectifs V1 et V2. Le premier contient n1 mole d'un gaz parfait caractérisé par gamma1 et à la température T1 et le second n2 moles d'un gaz parfait caractérisé par gamma2 et à la température T2. On met en contact les deux gaz inerte chimiquement l'un envers l'autre en otant la séparation (ce qui ne nécessite aucun travail) 1-Donner l'expression dans l'état final du mélange des paramètres d'état de volume Vf, pression Pf et température Tf.
2-Déterminé la variation totale d'entropie DSt lors de cette opération.
3- Déterminer la variation d'entropie DS' qui aurait résulté du passage des deux gaz de leur état initial à l'état Pf, Tf.
4- on appelle entropie de mélange pour de gaz pris dans les mêmes conditions Pf, Tf l'entropie résultant de la diffusion de ces deux gaz l'un dans l'autre. Calculer cette entropie de mélange dans le cas ci contre.
Proposition de réponse
1- Tf=(n1T1+n2T2)/(n1 + n2)
Pf=+(n1+n2)RTf)/(V1+V2)
Tf=300,6K
Pf=3650Pa
2-
DSt= DS1+DS2
dS=| (dQ)/T avec | une intégrale
dQ peut s'exprimer de plusieurs manières.
Laquelle de ces formules faudra t-il utiliser? Selon n'importe lequel nous conduira au même résultat (ce qui ne se vérifie pas)
3-
Ici je pense que DS'=DS
Car on aura à utiliser la même formule.
4-
DSm=0 car DS=DS'.
Bonsoir
Comment obtiens-tu le résultat de la question 1 ? Il faut raisonner sur la conservation de l'énergie interne en tenant compte des valeurs différentes du coefficient de Laplace 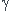 .
.
Pour la question 2 : tu peux considérer que l'entropie est une fonction extensive : la variation d'entropie est la somme des variations d'entropie des deux gaz :
 S=
S= S1+
S1+ S2
S2
Tu peux aussi utiliser la loi de Dalton sur les mélanges de gaz parfaits : chaque gaz se comporte comme s'il était seul en occupant la totalité du volume, à la température commune du mélange ais sous une pression égale à sa pression partielle. Cette fiche disponible sur l'ile de la physique te sera sans doute utile, en particulier la partie 6 :
![]() Deuxième principe de la thermodynamique
Deuxième principe de la thermodynamique
1-
Pour la question 1
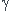 1=
1=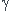 2
2
Ce qui a conduit au résultat trouvé.
2-
Pour la question2, j'ai du mal à me conformer au fichier pdf du faite qu'on pouvait simplement partir de la définition du différentiel de S:
En éffet dS=dQ/T
Et on aura l'expression de  S après intégration.
S après intégration.
Le problème est que dQ peut se mettre sous la forme de trois expression différentes :
Soient
dQ= CvdT+PdV
dQ=CpdT-VdP
dQ=CV(V/R)dP+Cp(P/R)dV
Donc on ne saura quelle expression de dQ à utiliser car chacune de ses expressions ne conduisent pas au même expression pour  S.
S.
Quelle sera donc l'expression à utiliser et pour quelle raison, s'il vous plaît.
Question 1 : dans l'énoncé tel que tu l'as recopié, rien n'indique : mais il s'agit peut-être d'une recopie incomplète.
Question 2 : le gaz n°1 passe de la température T1 et du volume V1 à la température Tf que tu as calculée et au volume Vf=V1+V2 ; l'expression de la variation d'entropie de ce gaz n° 1 est démontrée paragraphe 6.1.1 (formule 14) du document fournie. Méthode analogue pour le gaz n° 2 et puisque l'entropie est une grandeur extensive...
1-( Il s'agit éffectivement d'une recopie incomplète).
2- J'aimerais savoir si je pourrais utiliser soit la formule 20 ou 21 au lieu de la formule 14 que vous m'aviez recommandé ?
Oui : au lieu de raisonner comme je l'ai suggéré, sur les paramètres T et V, on peut aussi raisonner soit sur P et T, soit sur P et V.
Attention tout de même : la pression finale de chaque gaz n'est pas la pression totale mais la pression partielle de chaque gaz. Donc : raisonnement possible mais un peu plus long.


