Inscription / Connexion Nouveau Sujet
Thermodynamique
Bonjour, j'espère que vous allez bien. J'ai du mal à comprendre cette exercice.
Sur une bouteille en acier, on trouve les indications suivantes :
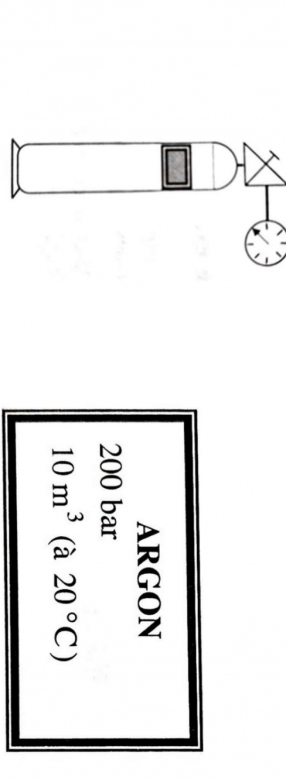
Elle est indiquée d'un détenteur pour l'argon à la pression atmosphérique, à la même température.
1) Quel est le volume interne de la bouteille ?
2) A) Quel est le volume utile de l'argon ?
b) Quel est la masse d'argon qui demeure dans la bouteille en fin
d'utilisation ?
On donne : Masse molaire de d'argon qui demeure dans la bouteille en fin d'utilisation.
PS: Cet exercice nécessite une interprétation des indications portées sur l'étiquette…La pression indiquée (appelée « pression de service ») est une pression relative ! la pression réelle du gaz est donc de 201 bar. Evidemment, le volume intérieur de la bouteille ( appelé volume en eau), n'est pas égal à 10 m³. Ce volume serait celui du gaz s'il était à la pression atmosphérique et à la température de 20 °C
Merci d'avance !
Bonjour
La loi des gaz parfaits s'applique à l'argon supposé être à la pression atmosphérique. Cela permet de répondre aux questions.
Déjà je voulais savoir que représente les indications.
Au prime abord j'avais compris que c'était le volume de la bouteille.
Du coup pour calculer le volume interne ( que j'avais compris comme étant le volume du gaz a l'intérieur de la bouteille), j'ai posé : Vint= PV/Pint. D'où Vint=1,013.10⁵ × 10/201×1,013.10⁵
Lorsque la bouteille est relié au milieu extérieur par l'intermédiaire du détendeur, en fin d'utilisation, les 10m3 à la pression atmosphérique sont répartis en deux :
- le volume interne sous la pression atmosphérique, qui ne peut sortir de la bouteille ;
- le volume sorti de la bouteille sous la pression atmosphérique qui constitue le volume utile.
Imagine deux récipients reliés par une canalisation contenant du gaz. Le gaz va s'écouler spontanément du récipient où la pression est la plus élevée vers le récipient où la pression est la plus faible et l'écoulement s'arrêtera dès que les pressions deviendront égales dans les deux récipients.
Ici l'air atmosphérique joue le rôle de second récipient, un récipient tellement grand que la pression ne varie pas par l'arrivée d'argon. Dès que la pression d'argon dans la bouteille atteind la pression atmosphérique, la bouteille cesse de se vider.
Mais sachant que le volume interne c'est celui qui ne sort plus parce que la pression interne devient égale à celle a l'extérieur. On aura a la fin d'utilisation : PVint=RnT ? Et non pas PintVint=RnT ?
Tes notations ne sont pas très précises, tu n'indiques pas la signification de P et de n. Pour la question 2b), on peut utiliser l'indice "int" pour l'intérieur de la bouteille. Comme déjà expliqué, en fin d'utilisation la pression intérieure est égale à la pression extérieure, c'est à dire à la pression atmosphérique arrondie ici semble-t-il à 1bar. La quantité nint de gaz restant à l'intérieur de la bouteille vérifie :
Pint.Vint=nint.R.T où T désigne la température commune.
Une fois connue nint, il suffit de connaître la masse molaire de l'argon pour obtenir mint : la masse d'argon restée dans la bouteille.
La quantité nint de gaz restant à l'intérieur de la bouteille vérifie :
Pint.Vint=nint.R.T où T désigne la température commune.
Mais en fin d'utilisation, Pint=P ?
Parce que vous avez dit que en fin d'utilisation le volume interne c'est celui qui ne sort pas vu que la pression atmosphérique interne devient égale à la pression extérieur.
Pint=Patm : la pression atmosphérique. Donc :
Pint=1,013bar.
Tu n'as pas précisé ce que tu notes : "P"...
OK pour la relation concernant l'argon dans la bouteille. C'est uniquement celle-ci qui est utile ici car elle permet de calculer nint : la quantité d'argon restante en fin d'utilisation lorsque Pint=Patm.
Donc : Patm. Vint=nint.R.T
L'atmosphère qui nous entoure est de dimensions tellement grandes que Vatm et natm ne sont pas définies mais peu importe : cela n'est pas utile au problème. Et surtout : l'atmosphère est essentiellement constituée d'air : dioxygène et diazote essentiellement.
C'est justement ce que tu peux calculer car tu connais toutes les autres grandeurs apparaissant dans la formule.
Ensuite,connaissant la masse molaire de l'argon,tu pourras répondre à la question posée en calculant la masse d'argon dans la bouteille.


