Inscription / Connexion Nouveau Sujet
Thermodynamique
Bonsoir j'aimerais un peu d'aide pour cet exercice. Merci
ENONCE
On considère un récipient vide, de volume , dont les parois sont calorifugées. On perce un trou dans la paroi de sorte que de l'air ambiant (pression
et température
) y pénètre de façon adiabatique (très rapidement).
1. Déterminer la température finale de l'air à l'intérieur du récipient.
2. Déterminer l'entropie créée. Conclure.
Bonsoir
Pour raisonner sur un système fermé, tu choisis comme système à l'état initial le récipient vide ainsi que le volume Vo d'air extérieur sous à pression Po à la température To. L'état final est constitué du récipient et de la quantité d'air initialement à l'extérieur et maintenant à l'intérieur du récipient à la température Tf inconnue sous la pression Po. En effet : on peut considérer que l'air extérieur arrête de pénétrer dans le récipient dès que la pression de l'air intérieur devient égale à la pression extérieure.
Tu peux alors appliquer la relation :  U=W+Q en supposant négligeable la capacité thermique du récipient.
U=W+Q en supposant négligeable la capacité thermique du récipient.
OK pour Q=0.
le volume Vo n'est ce pas pour le recipient ? Pourquoi vous dites que c'est le volume de l'air. Je n'arrive pas à comprendre
De plus on dit que initialement le récipient est vide donc son volume est Vo mais de la manière que vous expliquez c'est comme si le récipient est constitué de deux volumes, le sien et celui de l'air, alors qu'il est vide initialement.
Oui mais, pour que l'on puisse raisonner sur un système fermé (quantité de matière fixe), on choisit comme système le récipient vide et la quantité d'air primitivement à l'extérieur mais à l'intérieur du récipient à l'état final. Le reste de l'air constitue le milieu extérieur, celui qui exerce une force de pression sur l'air du système pour le faire entrer dans le récipient.
donc si je résume :
initialement le récipient vide est constitué d'air donc son volume est v_0+v_air
à l'état final l'air rentre complètement on a donc Vf = v_air
Merci beaucoup
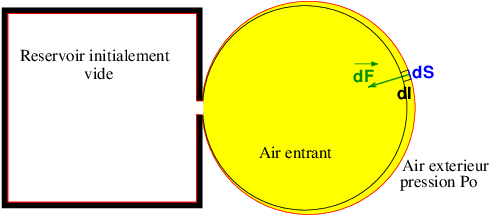
Récipient vide : il a été relié préalablement à une pompe à vide qui a enlevé l'air qui s'y trouvait. Un récipient vide ne contient rien. Dès qu'il est mis en contact avec l'air extérieur, de l'air extérieur rentre à l'intérieur de façon à égaliser les pressions entre l'intérieur et l'extérieur. C'est cet air qui rentre dans le récipient qui constitue le système étudié ici.
Ce schéma pourra peut-être t'aider. Le système fermé auquel on applique les lois de la thermodynamique a pour frontière la surface dessinée en rouge. A l'instant initial où on ouvre le robinet permettant l'entrée d'air dans le récipient, le récipient est vide (rien à l'intérieur, surtout pas d'air !). Le système à l'instant initial comprend l'intérieur du récipient et une bulle d'air de Volume Vo sous la pression Po à la température To. La bulle d'air n'est pas nécessairement sphérique mais une bulle sphérique est plus facile à dessiner...
Pour calculer le travail de la force de pression exercée par l'air extérieur (celui qui ne rentre pas dans le récipient, tu peux d'inspirer du schéma...