Inscription / Connexion Nouveau Sujet
thermodynamique
Bonjour,
Je réalise un exercice et deux questions me chagrinent :
Soient 3 mol de gaz parfait monoatomique, avec γ= 5/3, dans l'état initial :po= 100 kPa , V0 = 74,8 L , T0 = 300 K)
b. Il subit une compression adiabatique jusqu'à l'état final (p1 = 150 kPa ,V1 , T1 = 359K). Calculer V1.
c. Il subit une compression isotherme jusqu'à l'état final (p1 = 150 kPa ,V1 , T1 = 359 K ). Calculer V1.
en fait, je pensais utiliser PV=nRT dans les deux cas (on ne peut pas utiliser Laplace ici), mais les résultats seront bien sur identiques; donc je me demande dans lequel des deux cas cela n'est pas utilisable, et ce qu'il faut utiliser à la place ?
voilà un conseil serait bienvenu,
bonne journée
Bonjour
compression isotherme : la loi des gaz parfait conduit effectivement à un produit P.V identique à l'état initial et à l'état final.
compression adiabatique : si elle est aussi réversible, tu peux utiliser la loi de Laplace : le produit PV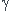 est identique à l'état initial et à l'état final.
est identique à l'état initial et à l'état final.
Merci pour ta réponse!
dans la question a. (qui n'est pas ici) la compression était effectivement adiabatique réversible; mais ici ce n'est pas précisé, donc je ne pense pas pouvoir utiliser Laplace donc si je ne peux pas non plus utiliser PV=nRT, je suis un peu bloqué...
La situation est assez simple : puisque des six valeurs : Po,To,Vo,T1,P1,V1, cinq sont fournis. La loi des gaz parfait fournit la réponse.
Problème tout de même :
Comment peut-on avoir T1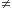 To pour une compression isotherme ?
To pour une compression isotherme ?
Erreur de copie de ta part ?
Donc P0V0/T0=P1V1/T1 => V1 = P0V0T1/P1 ;
oui, c'est bizzare pour T1 et T0, mais il n'y a pas d'erreur de recopiage donc il doit y avoir une erreur dans l'énoncé....
sinon, pour la question b. il est aussi demandé si la compression est réversible; donc je regarde si la variation d'entropie = 0; or compression adiabatique donc entropie échangée =0; donc je cherche à calculer l'entropie créée avec : et je compare avec 0; est-ce correct ?
pour la c. on me demande de calculer la variation d'entropie et j'utilise la même formule, merci d'avance
Pour la 2 : deux méthodes possibles :
1° : celle à laquelle tu penses qui est tout à fait correcte, consistant à exprimer  S pour un gaz parfait ;
S pour un gaz parfait ;
2° : voir si , oui ou non, la loi de Laplace est vérifiée.
Pour c : ta méthode est a priori la bonne mais comme il y a une erreur d'énoncé ... ???


