Inscription / Connexion Nouveau Sujet
thermochimie
Bonjour besoin d'aide sur cet exo:
connaissant les valeurs de Δ à 25°C et 1 atm correspondant aux réactions suivantes:
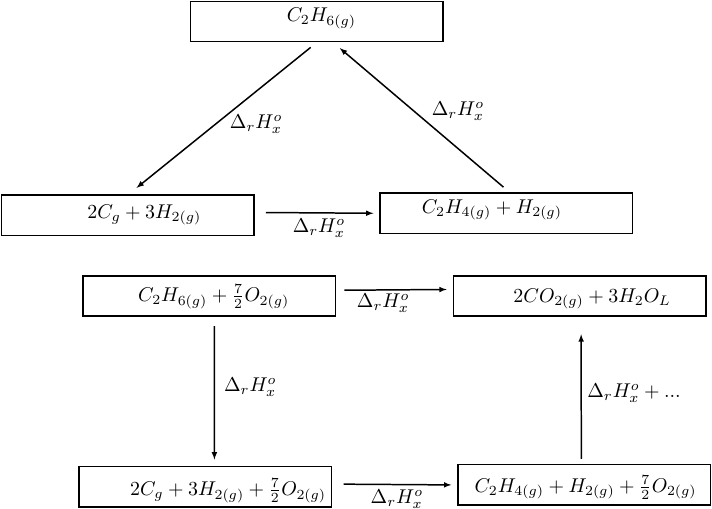
(1)C2H6(g)+7/2O2(g)--------->2CO2(g)+3H2O(l) ΔH1=-372.8kcal
(2) H2(g)+1/2O2(g)--------->H2O(l) ΔH2=-68.3kcal
(3)2C(graphite)+3H2(g)-------->C2H6(g) ΔH3=-20.2kcal
(4)2C(graphite)+2H2(g)-------->C2H4(g)ΔH4=12.6kcal
comment calculer
1.ΔU lors de la réaction d'hydrogénation de l'éthylène à 25°C selon l'équation
C2H4(g) +H2(g)--------->C2H6(g)
2.l'enthalpie de combustion de l'ethylène à 25°C
Bonjour
Cet énoncé semble très ancien : la calorie n'est plus une unité légale depuis plusieurs dizaines d'années. De même, depuis 1980 environ, les conditions standard correspondent à 1bar=105Pa et non 1atm, même si l'écart entre les deux est faible...
La méthode consiste à décomposer la réaction (1) en plusieurs étapes, les premières consistant à décomposer l'éthane en carbone et les autres à former de l'éthène puis de l'éthane. L'enthalpie étant une fonction d'état, la variation d'enthalpie est la même par les deux chemins. Cette égalité va te fournir l'enthalpie standard de la réaction qui t'intéresse. On passe ensuite de l'enthalpie standard de réaction à l'énergie interne standard de réaction par la relation :
 rH° =
rH° =  rU° +
rU° + 
 g.R.T
g.R.T
avec :

 g = (somme des coefficients stoechiométriques des produits à l'état de gaz) - (somme des coefficients stoechiométriques des produits à l'état de gaz.
g = (somme des coefficients stoechiométriques des produits à l'état de gaz) - (somme des coefficients stoechiométriques des produits à l'état de gaz.
Pour la réaction qui t'intéresse :

 g=1-2=-1
g=1-2=-1
Attention : il ne faut pas confondre la variation d'enthalpie d'un système, notée  H avec une enthalpie standard de réaction notée
H avec une enthalpie standard de réaction notée  rH° ...
rH° ...
Les deux schémas ci-dessous devraient t'aider, sous rserve bien sûr que tu aies compris le cours correspondant. Celui du haut correspond à la première question, celui du bas à la seconde. A toi de réfléchir et de compléter ; en particulier les indices des diverses enthalpies standard de réaction...