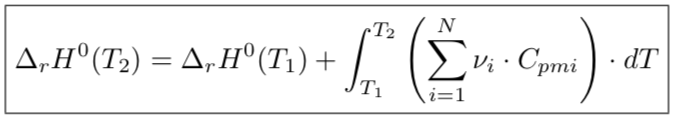Inscription / Connexion Nouveau Sujet
thermochimie
Bonsoir,
En preparant mes partiels de réactivité des systèmes chimiques, je me suis rendue compte que quelques questions en thermochimie me posent problème. Pourriez-vous m'aider?
voici mes questions avec l'énoncé:
- comment savoir si une réaction est thermodynamiquement favorable ? justifiez votre réponse.
cela dépend t'il de l'entropie S? dans ce cas comment justifier?
voici les données pour mes autres questions :
- quel est l'effet d'une augmentation de la température sur le déplacement de cet équilibre? justifier la réponse.
je ne vois pas du tout quoi répondre ici...
-Quel est l'effet d'une augmentation de la pression totale sur le déplacement de cet équilibre? justifier la réponse.
Je pense que c'est en lien avec la loi PV= nRT et les pressions des gaz mais je ne vois pas comment répondre.
- A 350K, tous les composés intervenant dans cette réaction sont gazeux. Calculer accompagnant cette réaction à cette température. Comparer a
.
j'ai trouvé .
pour cette question je sais que : . On a à faire à un changement de température donc pour moi on utiliserais
le problème c'est que nous n'avons pas m, ni n. Comment puis-je faire pour résoudre cette question?
merci d'avance pour votre aide 

petite rectification pour la première question, la question exacte est:
- la réaction est-elle thermodynamiquement favorable? justifiez votre réponse.
Bonsoir
Quelques éléments de réponse...
Remarque préliminaire : faire bien attention à la rigueur des notations afin de ne pas confondre une grandeur standard de réaction, en général notée  rH°,
rH°,  rS° ... avec une variation de fonction d'état produite par une réaction chimique, noté
rS° ... avec une variation de fonction d'état produite par une réaction chimique, noté  H,
H,  S...
S...
comment savoir si une réaction est thermodynamiquement favorable ? justifiez votre réponse.
Le signe de
 rG° donne le résultat le plus souvent. Puisque la constante d'équilibre thermodynamique a pour valeur :
rG° donne le résultat le plus souvent. Puisque la constante d'équilibre thermodynamique a pour valeur :
K=exp(-
 rG°/(RT)) alors que l'enthalpie libre standard de réaction a en général une valeur absolue de l'ordre de la centaine de kJ/mol, voire plus, une enthalpie libre standard de réaction négative correspond à K>>1 donc à une réaction très déplacée dans le sens direct à l'équilibre. Inversement
rG°/(RT)) alors que l'enthalpie libre standard de réaction a en général une valeur absolue de l'ordre de la centaine de kJ/mol, voire plus, une enthalpie libre standard de réaction négative correspond à K>>1 donc à une réaction très déplacée dans le sens direct à l'équilibre. Inversement  rG°>0 ... Je te laisse conclure...
rG°>0 ... Je te laisse conclure...
Pour la suite, il faut connaître les lois de Van t'Hoff et Le Chatelier...
Dernière question : l'extrait de table thermodynamique permet de déterminer l'enthalpie standard de réaction et l'entropie standard de réaction à 298K. Les valeurs des capacités thermiques molaires isobares permettent de déterminer ces grandeurs à 350K (loi de Kirchhoff)...
Si nécessaire, tu trouveras le cours correspondant ici, paragraphes II.6 et II.7 :
Bonsoir,
Merci pour votre réponse.
J'en déduit donc que:
pour ma première question:
donc k << 1 donc réaction très déplacée dans le sens indirect de l'équilibre (soit vers la gauche)
mon est de 17,48 KJ.mol-1 donc >0 donc la réaction est déplacée vers la gauche (sens indirect ou sens 2) donc vers les produits donc la réaction serait favorable?
pour la question sur l'augmentation de la température:
après quelques recherche j'en conclu que : "si on augmente la température d'un système, celui-ci s'y oppose en sen se déplaçant dans le sens qui absorbe la chaleur, c'est a dire dans le sens qui marque la réaction endothermique, il s'agit donc d'une réaction endothermique."
Dans notre réaction le système évoluerais donc de droite a gauche pour absorber la chaleur?
pour la question sur l'augmentation de la pression totale sur le déplacement de l'équilibre:
le système va également évoluer dans le sens qui tend à s'opposer à cette perturbation, donc ici il évoluera de droit vers la gauche pour équilibrer le nombre de moles de gaz (pour moi il y a 1 mole de gaz a gauche et 1 et demi à droite)
Mes raisonnements et justifications sont ils juste? je suis un peu confuse sur ces questions car ce ne sont pas celles que nous avons le plus traité en thermo 
dernière question:
voici les valeurs que j'ai pour = 2,2 KJ/mol-1 et
= -51,3 J.mol-1k-1 (application de la loi de Hess pour chacune de ces valeurs). J'ai définis ces valeur dans des questions précédemment selon le tableau et a 298K.
Si j'ai bien compris la loi de Kirchhoff qui est dans le cours que vous m'avez envoyé,
je dois appliquer la 1er loi de Kirchhoff qui utilise juste une variation de température comme nous avons et l'enthapie de réaction à une température T1 soit dans notre cas, à 298K.
Ce qui serait: (formule en pièce jointe)
Apres l'intégrale de T2/T1, je ne vois pas quelle valeurs mettre pour compléter la formule... (je n'ai jamais utilisé cette formule)
Je pense que tu as compris l'essentiel du cours mais je ne suis pas d'accord avec tous tes calculs.
Je crois que tu as bien compris les deux lois de modération de Van t'Hoff et Le Chatelier et tes conclusions sont logiques compte tenu de la valeur de  rH° que tu obtiens.
rH° que tu obtiens.
Il te faut revoir le calcul de  rH° et
rH° et  rS° : je n'obtiens pas les mêmes signes que toi : tu n'aurais pas permuté réactifs et produits dans le calcul ?
rS° : je n'obtiens pas les mêmes signes que toi : tu n'aurais pas permuté réactifs et produits dans le calcul ?
Pour l'application des deux lois de Kirchhoff, la formule générale se simplifie dans la mesure où ton énoncé demande de considérer les capacités thermiques molaires isobares comme indépendantes de T :
En posant :
Cela ne semble pas demandé ici mais tu aurais aussi :
J'ai repris tout l'exercice depuis le début pour que cela soit plus clair.
Pour je trouve toujours le même résultat qu'au début, en revanche pour
mon résultat est différent. J'ai mis le raisonnement que j'ai appliqué pour trouver ces résultats. Je pense qu'il y a une erreur car lors du calcul de K je trouve une valeur beaucoup trop élevée mais je ne comprends pas d'où celle ci vient.
Une réaction évolue t'elle toujours vers le produit pour être endothermique ? (en lien avec la question sur l'augmentation de température)
Concernant la loi de Kirchhoff, je l'appliquerai quand je serais sûr de la valeur de mon .


C'est bien ce que je pensais : tu as inversé produits et réactifs. Une réaction s'écrit dans le sens :
réactifs = produits
Ici N2O5 est le réactif.
On obtient dans ces conditions :
 rH° = -2,2kJ/mol
rH° = -2,2kJ/mol
 rS° = 51,3J.K-1.mol-1
rS° = 51,3J.K-1.mol-1
 rG° = -17,5kJ/mol
rG° = -17,5kJ/mol
K=1,16.103
Le sens endothermique est donc le sens inverse soit le sens de formation de N2O5.
Ce que je ne comprends pas c'est qu'on a N2O4 (g) + (1/2) O2 gaz, pourquoi ce sont les produits alors que ce sont eux qui réagissent ? À moins que je me trompe...
Depuis le collège, tu as toujours écrit une réaction chimique sous la forme :
 A +
A +  B
B 
 C +
C +  D
D
A gauche de la flèche : on indique les espèces chimiques avant réaction : les réactifs (A et B ici) ; à droite de la flèche, on indique les espèces qui sont "produites" par la réaction : les produits (C et D).
Evidemment, la situation se complique ensuite avec l'étude de réactions susceptibles de se produire dans les deux sens et de conduire à des équilibres mais la convention donnée en collège reste valide pour le sens direct de la réaction.
Cela est rappelé au paragraphe II.1 du document dont je t'ai fourni la référence.