Inscription / Connexion Nouveau Sujet
Thermo
Bonjour je bloque à cet exercice :
Un cylindre de volume 22,4 L est fermé par un piston et contient 1 mol de dihydrogene (Gaz parfait) à une pression de 1 bar.
On laisse le gaz se détendre adiabatiquement de manière réversible au double de son volume initial, puis in le comprimé de manière isotherme pour le faire revenir à son volume initial.
1/ quelle est la plus basse pression atteinte par le gaz ? Idem température ?
2/quel est le travail au cours de la compression isotherme ? Et la pression finale ?
En appliquant la place pour la 1 je trouve que la plus basse pression c'est 2/po c'est à dire 2.10^-5 bar . Mais je n'y arrive pas pour la température
Merci d'avance pour votre réponse
Bonsoir
En appliquant la place pour la 1 je trouve que la plus basse pression c'est 2/po c'est à dire 2.10^-5 bar . Mais je n'y arrive pas pour la température
La loi de Laplace a trois expressions équivalentes qui ont toutes les trois leur intérêt selon le contexte :
Pour une isotherme, évidemment : P.V = constante...
Bonjour, merci de votre réponse mais je ne vois toujours pas comment trouver la température la plus basse ..
Bonjour
Serais-tu capable de représenter ces deux évolutions dans un diagramme de Clapeyron (courbes représentant les variations de P en fonction de V) ? Cela t'aidera à comprendre.
\Mais en réalité sur le diagramme on a une isotherme
Et une adiabatique réversible !
Voir ci-dessous... Le diagramme n'est pas à l'échelle.
En appliquant la place pour la 1 je trouve que la plus basse pression c'est 2/po
Es-tu conscient de l'énormité de ce que tu as écrit ? J'espère qu'il s'agit en fait d'une étourderie car écrire qu'une pression puisse être égale à l'inverse d'une pression : franchement...
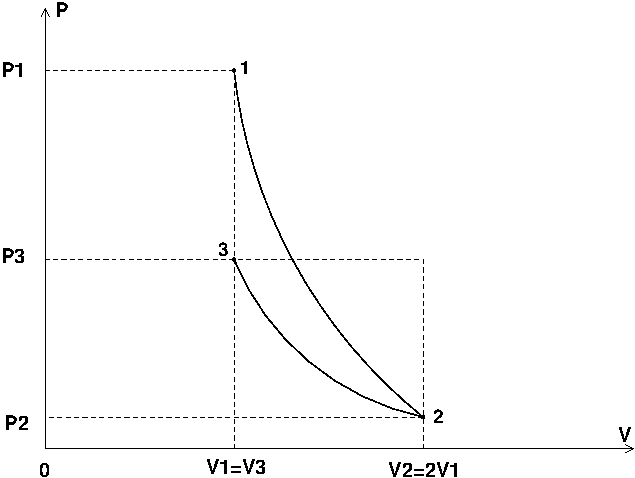
Quand je disais isotherme c'était seulement pour la deuxième transformation.
Oui je viens de me rendre compte désolé je me suis trompé dans la formule et sur le moment j'ai pas fait attention de ce que j'avais écrit
On a bien p1V1
 =p2V2
=p2V2
Oui !
Et
 =5/2 car c'est du dihydrogène
=5/2 car c'est du dihydrogène Non !
 =5/3 pour les gaz monoatomiques (argon, néon...) et
=5/3 pour les gaz monoatomiques (argon, néon...) et  =7/5 pour les gaz diatomiques comme le dihydrogène.
=7/5 pour les gaz diatomiques comme le dihydrogène.
La valeur
 =5/2 n'existe pas pour des gaz parfaits : l'écart doit être de 2 entre le numérateur et le dénominateur...
=5/2 n'existe pas pour des gaz parfaits : l'écart doit être de 2 entre le numérateur et le dénominateur...D'accord merci je n'avais pas les bonnes valeurs.
Don on peut en déduire que p1V1 =p22
=p22 V1
V1
?
Et donc j'en déduis facilement p2
Et donc j'en déduis facilement p2
oui ainsi que T2 : je t'ai indiqué précédemment la méthode.
L'étude de l'isotherme est plus facile...
Je dois etre bête j'ai beau tourné les formules dans tous les sens je n'y arrive pas (ne connaissant pas le volume initial ni la température initiale)
L'expression de P2 je l'avais trouvé c'était pour T2 que je n'arrivais pas.
Et même en écrivant :
P1V1=nRT1
P2V2=nRT2
On connais ni T1 ni T2 , V1 et V2 .


