Inscription / Connexion Nouveau Sujet
Structure matière 2
 etudiantilois
etudiantiloisBonjour,
J'ai des difficultés avec l'exercice ci-dessous.
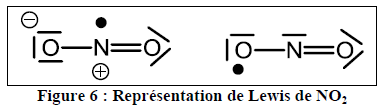
1. Donner les deux représentations de Lewis différentes de la molécule de dioxyde de sodium NO2. Quelle représentation vous semble la plus représentative de la molécule ?
2. Donner la représentation de Lewis, la formule structurale de Gillespie en AXmEn, le polyèdre de coordination et la géométrie de la molécule prévue par la méthode VSEPR de chaque représentation
3. Expérimentalement, l'angle ONO vaut 134°. Conclure sur la représentation de Lewis la plus représentative de la molécule.
J'ai du mal à comprendre comment il pourrait y avoir des représentations différentes pour la molécule de NO2. Apparemment dans le corrigé c'est celle de la figure ci-dessous, mais je ne comprends pas : à quoi correspondent le point et le plus de la représentation de gauche ? Dans quels cas met-on un point, une lacune, un moins, un plus ? Je m'embrouille…
Merci beaucoup par avance pour votre aide.
Bonjour
La figure 6 représente les deux formes mésomères extrêmes de la molécule. Chaque tiret correspond à un doublet de liaison ou à un doublet libre. Le point correspond à un électron de valence non apparié (électron célibataire).
Un "-" entouré d'un cercle désigne un excès d'une charge négative. Le nombre d'électrons au voisinage du noyau est égal au nombre de protons du noyau +1.
Un  désigne au contraire un déficit d'un électron.
désigne au contraire un déficit d'un électron.
Sachant que Z=7 pour N et Z=8 pour O, tu peux t'entraîner à vérifier.
Pour le reste, les articles sur ce sujet consultable sur le net sont nombreux....
J'ajoute tout de même une question :
Dans le corrigé de la question 3 il est écrit :
L'angle prévu par la géométrie VSEPR dans le cas d'une géométrie triangulaire est de 120°.
Jusque là, OK.
Ensuite il est écrit :
Pour la première représentation la répulsion entre l'électron célibataire et la double liaison est plus faible qu'entre la liaison simple et la double liaison : on attend donc un angle de liaison supérieur à 120°.
Pour la deuxième représentation la répulsion entre le doublet non liant et la double liaison est plus importante qu'entre la liaison simple et la double liaison : on attend donc un angle de liaison inférieur à 120°.
Je ne comprends pas du tout ces raisonnements...
Pourriez-vous me l'éclaircir un peu svp ?
Merci encore !
la répulsion entre l'électron célibataire et la double liaison est plus faible qu'entre la liaison simple et la double liaison : on attend donc un angle de liaison supérieur à 120°.
Il s'agit de répulsions de nature électrostatique entre électrons. La force de répulsion est d'autant plus forte que les charges électriques sont importantes donc que les nombres d'électrons sont grands.
La répulsion entre un électron célibataire et deux doublets de liaison est donc inférieure à la répulsion entre un doublet de liaison et deux doublets de liaison.
la répulsion entre le doublet non liant et la double liaison est plus importante qu'entre la liaison simple et la double liaison
A charges électriques identiques, les répulsions entre charges de même signes sont d'autant plus grandes que les distances moyennes entre ces charges sont faibles. Les doublets de liaisons correspondent à des électrons en mouvement autour de deux noyaux ; les doublets non liants restent localisés autour d'un noyau atomique. Je te laisse conclure...
Votre message d'hier à 23h54 est vraiment très clair, merci beaucoup !
Concernant celui de 15h51, j'ai une question :
comment savoir si l'on est en présence d'un carbanion ou d'un carbocation ?
Notamment lorsque l'on veut écrire les différentes formules mésomères d'une molécule ?
Merci encore.
Et quelle est la différence entre le carbocation et le carbanion ? Je sais que le carbocation ne respecte pas la règle de l'octet, mais c'est tout...
Comment savoir si l'on est en présence de l'un ou de l'autre ?
Merci beaucoup.
Tu peux trouver facilement sur le net (wikipedia pour les situations simples) des renseignements sur les carbocations et les carbanions. Il s'agit d'ions peu stables intervenant comme intermédiaires réactionnels. Rien de tel ici pour la molécule de dioxyde d'azote électriquement neutre comme toutes les molécules. Les formes mésomères sont des structures limites. Pour une molécule, elles font intervenir autant de (+) que de (-).
On peut prévoir les propriétés de la molécule en considérant que la structure réelle résulte d'un équilibre entre les différentes formes mésomères. Cela suffit en général à prévoir les propriétés essentielles de la molécule, en chimie organique notamment, ce qui est un objectif important du programme de BCPST. En réalité, cet équilibre est du à une délocalisation de certaines liaisons sur l'ensemble de la molécule. Cela s'étudie de façon plus précise à partir des orbitales moléculaires mais cela n'est pas un objectif important du programme.
Merci, je comprends mieux !
À propos de votre message du 16 août à 23h54, pour la molécule de gauche dans la figure 6, c'est bien l'angle entre N et le O de droite dans la molécule de gauche qui est supérieur à 120° ?
Merci pour votre réponse, mais là je ne comprends plus...
Alors ce serait comment pour la molécule de droite ?
Et il est où le troisième angle ?
Mais il n'y a qu'un seul angle de liaison : l'angle dont le sommet est le noyau N ! Je t'ai fourni un document où cet angle est représenté !
Une molécule linéaire (les trois noyaux alignés comme dans CO2) correspond à un angle de liaison de 180°. Je ne suis pas sûr que tu ais vraiment compris la méthode VSEPR...
Mais pourtant dans le corrigé de la question 3, il est écrit ceci :
L'angle prévu par la géométrie VSEPR dans le cas d'une géométrie triangulaire est de 120°.
Alors il devrait y avoir 3 angles puisque l'on parle de triangle, non ?
Évidemment les trois noyaux occupent les trois sommets d'un triangle isocèle (par raison de symétrie) dont le sommet est le noyau N. Seul l'angle de liaison est en général étudié, les deux autres pouvant aisément s'en déduire. Il n'y a pas de liaison chimique entre les deux atomes O. Il n'y a donc qu'un seul angle de liaison ! L'angle de liaison est, par définition l'angle entre l'axe de liaison entre N et le O de gauche et l'axe de liaison entre N et le O de droite. Le schéma en haut à droite du document wikipedia dont je t'ai fourni la référence est parfaitement clair !
Je ne peux vraiment pas faire mieux !


