Inscription / Connexion Nouveau Sujet
Structure matière 1
 etudiantilois
etudiantiloisBonjour,
Je ne comprends pas l'exercice suivant :
Bien qu'étant chimiquement inertes, certains gaz nobles, comme le xénon, de part leur position dans la classification périodique, peuvent former des molécules, Justifier.
Proposer une représentation de Lewis des molécules suivantes : XeF2, XeF4, XeF2O2, XeO3 et XeO4.
Pourriez-vous m'aider à le résoudre s'il vous plaît ? Comment des gaz nobles pourraient-ils effectuer des liaisons ?!
Merci beaucoup par avance pour votre aide.
Bonjour
Je me pose des questions sur le choix des exercices que tu proposes. S'agit-il d'exercices donnés par ton professeur ou d'exercices que tu trouves sur un livre sans toujours te rendre compte de leur niveau ?
Ces molécules ne respectent pas la règle de l'octet ; la théorie de Lewis ne s'applique pas ici. Bref : ce type d'exercice ne devrait être abordé que par des étudiants ayant de solides connaissances en atomistiques et en mécanique quantique ; les notions d'orbitales atomiques et d'orbitales moléculaires te sont-elles familières ? Si non : commence par chercher des exercices plus simples.
Quelques explications tout de même ici :
![]()
Bonjour,
Merci pour votre réponse.
C'est un exercice que j'ai eu pendant l'année scolaire dernière, donné par mon professeur...
Selon vous il est trop difficile pour le niveau de BCPST ?
Nous avons eu un chapître sur la structure électronique de l'atome, et nous avons donc un peu abordé les notions d'orbitales...
Mais j'avoue que c'est un cours qui n'est pas encore très clair pour moi, et pourtant j'ai fait des exercices... Mais c'est plutôt des exercices basiques que j'ai faits, auxquels on peut répondre sans avoir réellement compris la théorie qu'il y a derrière...
Je pense qu'il te faut d'abord bien revoir les notions d'atomistique. Sans avoir la prétention d'être complet :
Équation de Schrödinger ; application aux structures monoélectronique (atome H) : fonctions d'onde, nombres quantiques ; orbitales atomiques.
Bien comprendre que, si deux fonctions d'onde  1 et
1 et  2 sont solution de l'équation de Schrödinger, toute combinaison linéaire de ces fonctions d'onde est aussi solution de l'équation de Schrödinger. Cela aide ensuite à comprendre la notion d'hybridation des orbitales atomiques puis la notion d'orbitales moléculaires...
2 sont solution de l'équation de Schrödinger, toute combinaison linéaire de ces fonctions d'onde est aussi solution de l'équation de Schrödinger. Cela aide ensuite à comprendre la notion d'hybridation des orbitales atomiques puis la notion d'orbitales moléculaires...
Structures polyélectroniques : approximation monoélectronique de Slater ; répartitions des différents électrons : principe de stabilité, règle de Klechkovski, principe d'exclusion de Pauli, règle de Hund... Tableau périodique et principales propriétés des familles chimiques : électronégativité...
Sinon, pour revenir à l'énoncé de ton premier message, je ne pense pas que ce genre de structure moléculaire soit au programme de BCPST. Evidemment, on peut imaginer au concours d'entrée à l'ENS Ulm de traiter ce type de molécule mais l'énoncé guiderait le candidat... Pas question de poser ce genre de problème l'Agro...
Merci beaucoup pour votre réponse.
J'ai résumé avec l'aide de MetalOxalate ce qui me pose problème dans le post "Orbitales".
Peut-être pourriez-vous y jeter un coup d'il svp ?
Par exemple, ce schéma ci-dessous sur le diazote, je ne le comprends pas du tout...
Mais est-ce essentiel de comprendre cela en BCPST ? Ça risque de tomber au concours ?
Merci encore.
** image supprimée **
Sur ton schéma, l'axe (Oz) représente l'axe de liaison, axe passant par les deux noyaux d'azote.
Une liaison covalente  s'établit par combinaison linéaire des fonctions d'onde correspondant soit à deux orbitales admettant l'axe (Oz) comme axe de symétrie soit à une orbitale admettant l'axe (Oz) comme axe de symétrie et à une orbitale "s". (ici deux orbitales pz mais on pourrait envisager une OA pz et une OA s). L'essentiel à retenir :
s'établit par combinaison linéaire des fonctions d'onde correspondant soit à deux orbitales admettant l'axe (Oz) comme axe de symétrie soit à une orbitale admettant l'axe (Oz) comme axe de symétrie et à une orbitale "s". (ici deux orbitales pz mais on pourrait envisager une OA pz et une OA s). L'essentiel à retenir :
* L'orbitale moléculaire qui en résulte admet aussi l'axe (Oz) comme axe de symétrie ; quand cette liaison intervient entre deux atomes liés à d'autres atomes (liaison C-C dans CH2Cl-CHBr2 par exemple), la liaison  autorise la libre rotation autour de l'axe de liaison du groupe CH2Cl par rapport au groupe CHBr2. Cela est important à savoir quand il s'agit d'étudier les isomères dans ton programme.
autorise la libre rotation autour de l'axe de liaison du groupe CH2Cl par rapport au groupe CHBr2. Cela est important à savoir quand il s'agit d'étudier les isomères dans ton programme.
*Ces liaisons sont très stables comme le montre ton extrait de cours.
Une liaison covalente  s'établit par combinaison linéaire de deux fonctions d'onde correspondant à deux orbitales admettant des axes de symétrie parallèles entre eux (deux OA px par exemple). l'orbitale moléculaire qui en résulte admet comme plan de symétrie le plan contenant l'axe de liaison qui est perpendiculaire aux axes de symétrie des deux orbitales atomiques : le plan (Oyz) ici.
s'établit par combinaison linéaire de deux fonctions d'onde correspondant à deux orbitales admettant des axes de symétrie parallèles entre eux (deux OA px par exemple). l'orbitale moléculaire qui en résulte admet comme plan de symétrie le plan contenant l'axe de liaison qui est perpendiculaire aux axes de symétrie des deux orbitales atomiques : le plan (Oyz) ici.
Deux choses essentielles à retenir :
* une liaison  interdit la libre rotation autour de l'axe de liaison. C'est à cause de cette propriété qu'il est possible de distinguer des isomères Z et E ;
interdit la libre rotation autour de l'axe de liaison. C'est à cause de cette propriété qu'il est possible de distinguer des isomères Z et E ;
* une liaison  est moins stable qu'une liaison
est moins stable qu'une liaison  .
.
Voilà ce qui va surtout te servir dans le cadre de ton programme. Bien sûr, je résume beaucoup...
Merci beaucoup pour ces explications bien détaillées ! C'est très pratique quand vous écrivez "essentiel à retenir"...
Je crois avoir compris ce que vous écrivez. Par contre, au niveau de la schématisation dans l'extrait de cours envoyé, je ne comprends pas bien...
D'où proviennent ces formes grisées ou non ?
Et quelle est la logique à adopter derrière les 3 flèches blanches ?
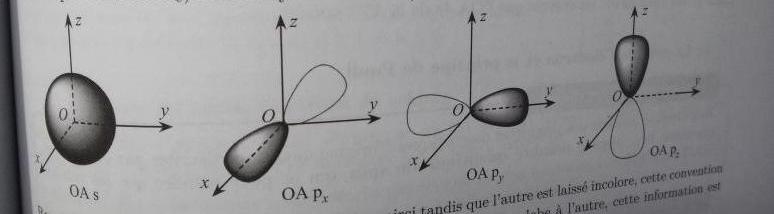
Tout ce que je connais pour la schématisation des orbitales, c'est ce qu'il y a sur l'image ci-dessous...
Merci encore pour votre aide !
Et j'ajoute une question liée à ce chapitre sur l'hypervalence.
Théoriquement, comment l'hypervalence s'explique-t-elle ?
J'ai compris quels atomes peuvent être hypervalents, mais malheureusement la théorie avec les orbitales qu'il y a derrière m'échappe...
Essentiel à retenir sur les orbitales atomique en liaison avec tes questions :
OA de type s : la fonction d'onde ne dépend que de r, la distance au noyau : l'OA est à symétrie sphérique.
OA de type p : la probabilité de présence est maximale au voisinage d'un axe passant par le noyau. Pour cette raison les 3OA de type p (pour une valeur donnée de n supérieure à 1) sont notées px, py, pz.
Sur tes schémas, la partie grisée correspond à une fonction d'onde  >0, l'autre partie symétrique correspond à
>0, l'autre partie symétrique correspond à  <0. Cela n'est pas très important puisque tu dois savoir que la densité volumique de probabilité de présence de l'électron en un point est
<0. Cela n'est pas très important puisque tu dois savoir que la densité volumique de probabilité de présence de l'électron en un point est  2 et ne dépend donc pas du signe de
2 et ne dépend donc pas du signe de  . Le signe de
. Le signe de  intervient dans l'étude des combinaisons linéaires de fonctions d'onde ; ce calcul est utile pour l'étude des hybridations et l'étude des orbitales moléculaires. Peu d'importance en BCPST...
intervient dans l'étude des combinaisons linéaires de fonctions d'onde ; ce calcul est utile pour l'étude des hybridations et l'étude des orbitales moléculaires. Peu d'importance en BCPST...


