Inscription / Connexion Nouveau Sujet
Reduction oxydation
Bonsoir, je rencontre des confusions avec la notion de réduction oxydation
j'ai regardé mes cours et des vidéos mais je me sens a chaque fois de plus en plus embrouillé
j'ai lu quelque part que si l'espèce chimique a capté électron, alors c'est un oxydant
et si il a cédé un électron alors c'est un réducteur
mais pourtant quand je lis " le Fe2+ s'auto-oxyde, alors il devient un Fe3+"
je ne comprends pas, ne devrait il pas etre Fe+ puisqu'il a gagné une charge - ?
puis un peu de biochimie mais quand on dit que c'est que dans un milieu oxydant où 2 cysteines peuvent former des ponts disulfures, alors intuitivement je me dis que les fonctions thiols des cysteines SH sont réduits :
R-SH+R-SH -> R-S-S-R + (2H+) + 2e-
mais je vois sur internet que :
R-SH+R-SH ->(oxydation) R-S-S-R + (2H+) + 2e-
donc les cysteines sont réduits ou oxydés ?? parce qu'ils précisent 'oxydation"
pourtant quand on oxyde, on gagne des électrons or dans l'équation on voit bien qu'on en perd non ?
Merci de me guidé un peu 
Bonsoir
Pour éviter les confusions, tu peux penser à l'historique des noms. Le premier des oxydants connus est le dioxygène O2. Tu dois savoir que l'élément O est situé dans la partie droite du tableau périodique (6 électrons de valence) et à donc tendance à capter deux électrons. Logiquement le dioxygène est un oxydant ; généralisation : un oxydant est une espèce qui tends à capter un ou plusieurs électrons, en captant cet (ou ces) électron(s), il se transforme en son réducteur conjugué et subit donc une réduction. Ayant cela en tête, tu peux retrouver toutes les autres définitions sans crainte de confusion.
La transformation d'un réducteur en son oxydant conjugué est une oxydation : quand Fe2+ se transforme en son oxydant conjugué Fe3+, il perd un électron ; plus généralement, une oxydation est la transformation subie par un réducteur, donc une perte d'électron(s).
Cette demie équation résume mes propos précédents :
 moles d'oxydant, en captant n moles d'électrons, se réduisent en
moles d'oxydant, en captant n moles d'électrons, se réduisent en  moles du réducteur conjugué de ox.
moles du réducteur conjugué de ox.
transformation inverse :  moles de réducteur s'oxydent en
moles de réducteur s'oxydent en  moles de son oxydant conjugué en perdant n moles d'électrons.
moles de son oxydant conjugué en perdant n moles d'électrons.
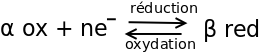
Daccord merci pour votre définition, je comprends déjà mieux !
donc si j'ai bien compris
quand on passe d'un reducteur a son oxydant alors c'est une oxydation
un oxydant à un réducteur alors c'est une réduction
daccords j merci, il faut juste que je fasse un peu d'exercices pour assimiler ces termes 
C'est bien cela ! Je crois que tu as compris. Sachant que l'oxygène est un oxydant et sachant que l'oxygène est électronégatif (attire les électrons), avec un peu d'entraînement, on ne se trompe plus !
Bonsoir à vous deux,
Cette fiche aussi peut servir dans tes révisions (clique sur la maison) : ![]() [lien]
[lien]


