Inscription / Connexion Nouveau Sujet
réaction chimique......
bien le salut a tout le monde 
voila, je voudrais comprendre l'équilibre des équations chimique.
exemple combustion du methane:
CH4+ O2 ---> CO2 + H2O
on remarque que le meme type d'atome qu'on trouve dans les reactifs on le trouve dans les produits, sauf que notre équation n'est pas équilibré en nombre d'atomes.
en équilibrant l'équation on trouve:
CH4 + 2 O2-------> co2 + 2H2o
En commentant l'équation :
on a ajouter dans le reactif dioxygene une nouvelle moleculle donc on a
(2 o2) pour obtenir un équilibre dans le produit mais je n'ai pas compris le 2 qu'on a ajouté avant le H de la moleculle d'eau 2H2o
du moment qu'on 4 atomes d'hydrogene dans le reactif (méthane).
dans l'équilibre de l'équation suivante:
2 CH4 + 4 o2------> 2co2 + 4H20
2CH4 en sachant que la mollecule de methane est constitué d'un atome de carbonne et de 4 atomes d'hydrogene (CH4).
es-ce-qu'on doit considéré en écrivant 2CH4 qu'on a deux mollecule de methane ou on a dans la mollecule de methane deux atomes de carbonne (je veux dire dans notre lecture de ce qui est ecrit).
pour le deuxieme réactifs (le dioxygene) c'est ecrit 4 O2 DONC, on a 4 moleculle de dioxygene c ca ?
pour le produit on trouve:
2 CO2 + 4 H2O DONC c'est deux moleculle de dioxyde de carbonne + quatre moleculle d'eau.
es-ce-que ma lécture et correcte et es-ce-que l'équation est équilibré?
amicalement adel
Salut !
!
Dans CH4 tu as 4 atomes d'hydrogène... Dans H2O tu as 2 atomes d'hydrogène.
Donc pr équilibrer tu dois mettre 2H2O...
Problème résolu ?!
Ah, ces réactions chimiques... T'en auras tout ton soûl en chimie au lycée...
Enfin, @+
donc ce que je dois comprendre :
H2 multiplié par 2 pour avoir les 4 atomes d'hydrogene qu'on avait dans le réactif c ca ce qu'on appelle équilibré ?
amicalement adel 
pour l'équilibre de l'équation chimique suivante:
2CH4+4 O2----->
2C 2O2+4 H22O2
d'apres ce qui est ecrit partie réactif on a deux molécules de methane et 4 molecules de dioxygene ou une molecule de methane ayant deux atomes de carbonne laquel des lecture et juste.
amicalement adel
Si je peux me permettre CH4+ 2O2  CO2 + 2H2O est équivalent à 2CH4+ 4O2
CO2 + 2H2O est équivalent à 2CH4+ 4O2  2CO2 + 4H2O
2CO2 + 4H2O
Car 2CH4+ 4O2  2CO2 + 4H2O
2CO2 + 4H2O 2
 (CH4+ 2O2
(CH4+ 2O2  CO2 + 2H2O)
CO2 + 2H2O)
On a multiplié tout les nombres stchiométriques par 2 ... On peut donc les simplifiés par 2 aussi.
Quant à l'explication, hum ... Il faut au minimum 1 mol de CH4 et 2 mol de O2 pour former 1 mol de CO2 et 2 mol d'eau.
Pour la deuxième équation : On a remarqué que l'équation 2 est équivalente à l'équation 1. Donc si l'on introduit deux fois plus de réactifs, on obtient deux fois plus de produits (Cf. stchiométrie ou raisonnement en terme de molle)
merci lavy t'es gentil
mais ce que je voulais savoir :
2CH4 + 4 O2 la lecture est: on a deux molecules de methane 4 molecules de dioxygene ou ( 2 atomes de carbone 4 d'hydrogenes et 4 molécules de dioxygene ce qui donne (8 atomes d'oxigene)?)
ou es-ce-que cette lecture est pas possible?
OK d'accord, ce n'était pas la question ^^'. Je vais quand même tenter de te répondre.
Pour moi, , tout d'abord parce qu'il est dangereux de faire ces allusions et pour une autre raison, qui est certainement hors du programe de quatrième. Je ne sais plus si on fait la géométrie des molécules de Lewis en quatrième ^^'.
Je vais quand même m'expliquer. Le Carbone a une géométrie tétraèdrique, pour faire simple, ça signifie qu'il peut faire quatre liaisons avec d'autres atomes. D'où la formule CH4. Le carbone fait quatre liaisons avec quatre hydrogènes !
Or si on considère 2CH4 = C2H8, on ne peut plus représenter la molécule ! deux carbones liés entre eux ne peuvent faire que six liaisons avec d'autres atomes ...
Pour faire simple, à mon humble avis : C2H8 n'existe pas !
De plus les nombres stchiométriques définissent le nombre de molle ( molécules) d'élément utilisées pour que la réaction est lieu !
Donc certes on peut dire que dans 2 mol de CH4, il y a 2 carbones et 8 hydrogènes. Mais ce n'est pas très rigoureux, surtout en terme de réactivité.
Donc si je dois lire : 2CH4 + 4O2  2CO2 + 4H2O je dirais :
2CO2 + 4H2O je dirais :
"Deux molles de méthane et 4 molles de dioxygènes réagissent et donnent ..." ou "Deux molécules de méthane et 4 molécules de dioxygènes réagissent et donnent ..." (puisque tu parles en terme de molécules ^^).
Par contre je ne dirais pas "Deux atomes de Carbones, huit d'hydrogènes, et 8 d'oxygène réagissent pour donner ...", à mon sens c'est aberrant enfin pas très logique plutôt, mais si ton professeur te dit le contraire, je pense que tu peux lui faire confiance  .
.
donc pour l'équilibre de notre équation chimique on a suivant le shemas :
2CH4 + 4 O2----> 2CO2 + 2H2O
cette équation n'est pas équilibré du moment qu'il nous manque des atomes d'oxygene  dans notre produit deux molecule de dioxygene dans le 2co2 une seule molecule de dioxygene dans le dernier produit 2h2o
dans notre produit deux molecule de dioxygene dans le 2co2 une seule molecule de dioxygene dans le dernier produit 2h2o
je pense qu'il nous manque une molecule de dioxygene non pour que l'équation soit équlibré?
amicalement adel 
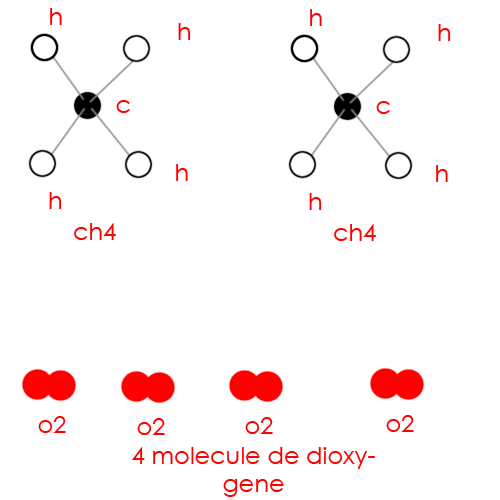
Salut !
!
Si tu as assez puisque c'est CH4 + 2O2 ---> CO2 + 2H2O.
Donc il te faut deux molécules de dioxygène pour une molécule de méthane
Euh je ne comprend pas bien pourquoi tu parles de cette réaction. D'autant plus que juste avant la réaction dont nous parlions c'était :
2CH4 + 4O2  2CO2 + 4H2O
2CO2 + 4H2O
Mais soit, pourquoi pas. Tu nous fais maintenant étudier la réaction : 2CH4 + 4O2  2CO2 + 2H2O.
2CO2 + 2H2O.
Moi je te répondrais qu'il manque deux molécules (molles) d'H2O ; je m'explique !
Avant la réaction tu as (réactifs) :
* 2 carbones
* 8 hydrogènes
* 8 oxygènes
Après la réaction tu as (produits) :
* 2 carbones
* 4 hydrogènes  Il manque 4 hydrogènes !
Il manque 4 hydrogènes !
* 6 oxygènes  Il manque 2 oxygènes !
Il manque 2 oxygènes !
Or dans 2H2O, il y a 4 hydrogènes et 2 oxygènes !
Donc : Il manque deux molécules d'H2O, dans les produits !!
La réaction équilibrée est donc 2CH4 + 4O2  2CO2 + 2H2O + 2H2O ce qui est équivalent à écrire : 2CH4 + 4O2
2CO2 + 2H2O + 2H2O ce qui est équivalent à écrire : 2CH4 + 4O2  2CO2 + 4H2O. (ce qui est équivalent à écrire CH4 + 2O2
2CO2 + 4H2O. (ce qui est équivalent à écrire CH4 + 2O2  CO2 + 2H2O)
CO2 + 2H2O)
On revient à l'équation de départ.
En résumé : Il ne manque pas 1 molécule de O2, mais plutôt deux molécules de H2O
Il ne manque rien du tout...
Pourquoi avoir doublé les coefficients?
la réaction que je donne et la tienne sont les mêmes!
je vais bosser, je reviens à 17h00, ma pause est terminée
Petite précision tout mon raisonnement se base sur la réaction que nous soumet Adel :
donc pour l'équilibre de notre équation chimique on a suivant le shemas :
2CH4 + 4O2 ----> 2CO2 + 2H2O
J'ai doublé le coefficient du produit H2O, parce que le cas contraire : 2CH4 + 4O2
 2CO2 + 2H2O n'est pas équilibrée ça me semble évident.
2CO2 + 2H2O n'est pas équilibrée ça me semble évident.
Concernant 2CH4 + 4O2
 2CO2 + 4H2O ou CH4 + 2O2
2CO2 + 4H2O ou CH4 + 2O2  CO2 + 2H2O
CO2 + 2H2O
Je suis d'accord il ne manque rien ... D'autant plus que se sont les même

Au risque de me répéter ...
2CH4 + 4O2
 2CO2 + 2H2O n'est pas équilibrée ça me semble évident
2CO2 + 2H2O n'est pas équilibrée ça me semble évidentJ'ai bien écrit cette équation n'est pas équilibrer, cette équation est fausse ! Pour l'équilibrer ... Il suffit d'ajouter 2H2O ...
Ce qui donne 2CH4 + 4O2
 2CO2 + 4H2O.
2CO2 + 4H2O.
Jusqu'à preuve du contraire je pense que c'est ce que j'ai dit il y a 5 messages ... Recompte les atomes de l'équation ci-dessus, tu constatera qu'elle est parfaitement équilibrée. Et convint toi que je n'ai fait qu'ajouter 2H2O à cette équation 2CH4 + 4O2
 2CO2 + 2H2O
2CO2 + 2H2O
2CH4 + 4O2
 2CO2 + 2H2O + 2H2O
2CO2 + 2H2O + 2H2O
Recompte encore les atomes et tu constatera que c'est à nouveau parfaitement équilibré ^^'.
C'est ce que j'affirme depuis cinq messages maintenant ^^'.


