Inscription / Connexion Nouveau Sujet
Radioactivité
Bonjour,
Auriez vous une idée d'aborder cette question?
Calculer la masse de sodium 24 (de durée de vie T = 15h) pour que le débit de l'émission à t= 0 soit
équivalent à un courant électrique de 0,1 mA.
D'avance merci.
Je trouve la question mal formulée car la notion de "débit" dans un tel contexte est quasi un sacrilège.... mais enfin passon, on voit l'idée:
quand le Na24 se désintègre, parmi les produits de décomposition, je suppose qu'il y a 1 ou plusieurs électrons (tu peux regarder sur wikipédia si cela ne t'est pas donné dans ton problème) qui sont libérés.
Il faut donc calculer le nombre de désintégration qu'il te faut en t=0 (N0 dans la formule N(t)=N0e (-t/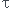 ) )qui donne un nombre total d'électron égal à un courant de 0.1mA. Connaissant la proportion relative de l'isotope N24 dans du Na , tu dervais obtnier le résultat sans trop de peine.
) )qui donne un nombre total d'électron égal à un courant de 0.1mA. Connaissant la proportion relative de l'isotope N24 dans du Na , tu dervais obtnier le résultat sans trop de peine.
J'espère que ces indications te suffiront.
Bonne continuation
Un peu d'info:
Concernant le Na24:
11 protons, 13 neutrons, durée de demi-vie = 14.96 h, fraction présente naturellement dans du Na23 il est uniquement synthétisé, pas d'isotope naturel donc on peut partir d'une masse de sodium composée de 100% de Na24 pour le problème.
2411Na  2412Mg + 0-1e +
2412Mg + 0-1e + 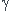 (ou X)
(ou X)
Donc 1 e- par désintégration.
Nombre d'électron dans un courant de 0.1 mA:
N = 0.1 10-3 [A] / (1,6
10-3 [A] / (1,6 10-19 [As]) = 6.25
10-19 [As]) = 6.25 1014 [s-1]
1014 [s-1]
l'unité n'est pas innocente. Dans l'énoncé du problème on demande une équivalence entre un nombre de particule qui sont émises en grand nombre mais instantanément (N(t) en chaque t) et un courant c'est à dire une quantité d'électron qui passent par unité de temps.
Donc là on est emprunté, 2 approches possibles:
- on veut équilibré une charge instantanée donc on regarde ce qui se désintègre en t=0 et on le compare à la charge totale qui passe en 1 sec (c'est ce que j'0avais supposé au départ)
- on intègre N(t) sur la première seconde (entre t=0 et t=1sec) et c'est cette quantité qu'on compare au nombre de charge sur 1 sec,
la 2ème me plaît plus personnellement, si on devait monter le truc dans un labo ce serait bien de ça dont il s'agirait...
je pense que ces info t'aideront à arriver au bout
Je mâper4ois que dans l'énoncé il parle bien de la valeur instantannée en t=0. Donc ma dernière phrase n'a pas lieu d'être. Décidément, je trouve ce problème de plus en plus mal fichu... (dans la cas où on intégrait sur la première seconde, je trouve 73gr de Na24)
Je me suis embrouillé, je me suis trompé quand j'ai donné la valeur sur 1 seconde...
Je m'explique:
- le nombre d'atomes de l'isotope radioactif présent initialement dans l'échantillon est N0.
- le nombre d'atomes de l'isotope radioactif non désintégrés restant à l'instant t est N(t) = N0e(-t/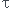 )et donc le nombre d'atomes qui se sont désintégrés durant l'intervalle de temps [0,t] est (N0 - N(t)) = N0[1 - e(-t/
)et donc le nombre d'atomes qui se sont désintégrés durant l'intervalle de temps [0,t] est (N0 - N(t)) = N0[1 - e(-t/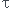 )]
)]
****************************************
Mais quid de ton exercice ?
La dérivée en t de n(t) donne la valeur instantanée du nombre de désintégration par seconde:
dN/dt = -(N0/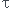 )e(-t/
)e(-t/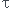 ) (le moins indique juste une décroissance, on laisse tomber...)
) (le moins indique juste une décroissance, on laisse tomber...)
En t=0 est : N0/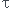 ) qui doit être égale à 6.251014 => N0 = 3.38
) qui doit être égale à 6.251014 => N0 = 3.38 1019
1019
soit 5.6110-5 mole => masse = 1.29 mg
Bon j'espère sans faute cette fois 
Merci beaucoup pour votre aide.
De mon côté, je trouve : 1,9 mg.
Je suis parti de la définition de l'intensité : i = dq/dt (à t=0) = F d(n(e-))/dt
= F dN(e-))/dt/Na (ou Na est le nombre d'Avogadro). = e dN(e-)/dt = e(-d(N)/dt) = lambda N0e =
ln2/(t1/2) m/M Na e et en en déduit m.
Etes vous en accord ?
J'avoue que je ne connaissais pas la définition de l'intensité d'une désintégration  mais le raisonnement me semble clair:
mais le raisonnement me semble clair:
i (courant = nombre d'électron par unité de temps) = e (la charge obtenue à chaque désintégration d'un atome de Na) -dN/dt (qui est effectivement la variation u nombre d'atomes de sodium par unité de temps et donc le nombre de désintégrations par unité de temps...)
-dN/dt (qui est effectivement la variation u nombre d'atomes de sodium par unité de temps et donc le nombre de désintégrations par unité de temps...)
qui me semble être le raisonnement que j'avais suivi.
Qu'est ce que F dans ton cas ? Et qu'est-ce que ce t1 ?
merci de tes éclaircissements 
Bonjour Vilbrekin,
En fait, F est le Faraday (96500 C) et t1 est en fait t1/2 (période radioactive).
Mon application numérique est différente et je trouve 1,9 mg.
A bientôt,
Oui, effectivement j'ai fait une erreur en prenant pour 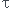 = 1/
= 1/ la valeur du demi-temps de vie alors que, comme tu l'as écrit, on a:
la valeur du demi-temps de vie alors que, comme tu l'as écrit, on a:
N(t) = N0e -( t)
t)
=> en t=t1/2 il reste N0/2 atomes non désintégrés: N(t1/2) = N0/2 = N0e-( t1/2)
t1/2)
=> e[-( t1/2)] = 1/2
t1/2)] = 1/2
=> -( t1/2) = Ln(1/2)
t1/2) = Ln(1/2)
=> - = -Ln(2)/t1/2
= -Ln(2)/t1/2
=>  = Ln(2)/t1/2 = 0.693/t1/2
= Ln(2)/t1/2 = 0.693/t1/2
Mais le reste du raisonnement était correct:
1 électron par désintégration  du Na23, donc dN/dt désintégration par seconde => e(-dN/dt) (t=0) électron émis par seconde en t=0 correspondant à un courant de 0.1mA (e est la charge de l'électron)
du Na23, donc dN/dt désintégration par seconde => e(-dN/dt) (t=0) électron émis par seconde en t=0 correspondant à un courant de 0.1mA (e est la charge de l'électron)
=> eN0 = 0.1
= 0.1 10-3
10-3
=> N0= 10-4/[e ] = 10-4
] = 10-4 t1/2/[1.6
t1/2/[1.6 10-19
10-19 Ln(2)]
Ln(2)]
= 10-4 5.4
5.4 104 / (1.6
104 / (1.6 10-19
10-19 0.693)
0.693)
= 4.87 1019 = 8.12
1019 = 8.12 10-5 mole
10-5 mole
Comme la masse d'une mole de Na23 est 23g, on trouve: 1.9 mg comme tu l'avais dit
Donc c'était bien ce facteur Ln(2) qui me manquait tout à l'heure puisque j'ai confondu temps caractéristique et temps de demi-vie. Honte à moi 
Bonne continuation à toi, sympa cette exercice finalement...


