Inscription / Connexion Nouveau Sujet
Question rapide - Analyse conformationnelle
 etudiantilois
etudiantiloisBonjour,
Il y a quelque chose que je ne comprends pas.
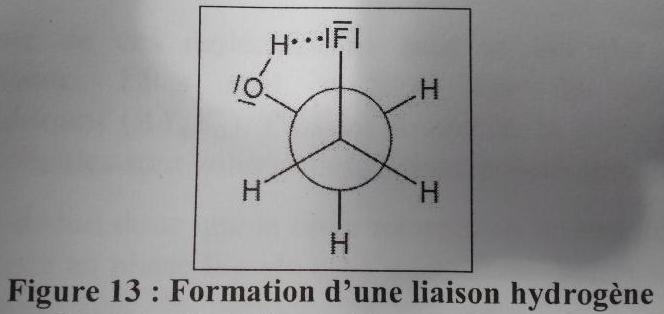
Dans le corrigé d'un exercice, il est indiqué que pour la molécule de 2-fluoroéthan-1-ol, c'est le conformère décalé gauche qui a la plus basse énergie.
Ils expliquent cela par le fait qu'il y a une liaison hydrogène (voir figure ci-dessous).
Mais je ne comprends pas : pour moi s'il y a une liaison intramoléculaire, il y aura donc une énergie PLUS importante, non ?
Merci beaucoup par avance pour votre explication.
Bonjour etudiantilois,
En fait, les liaisons hydrogènes vont faire baisser le niveau d'énergie.
Il faut voir ça comme une attraction  .
.
Il est plus facile de rapprocher 2 corps qui sont naturellement attirés l'un par l'autre, que le contraire  .
.
-> Il faut donc plus d'énergie pour l'éloigner l'hydrogène du fluor, que pour les rapprocher.
Bonne journée,
Metal Oxalate 
Merci pour votre réponse.
Malheureusement là je ne comprends pas...
Je suis vraiment désolé...
Peut-être que c'est "niveau d'énergie" que je ne comprends pas ?
En thermodynamique, as-tu déjà entendu parlé d'énergie interne (U ), d'enthalpie (H ) et d'entropie (S ) ?


