Inscription / Connexion Nouveau Sujet
problème de solubilité
Bonjour à tous,
J'ai quelques doutes sur la résolution du problème suivante :
On décide d'ajouter du à une solution à la fois 0.5 M en
et
Quel est le sel de plomb qui précipitera le premier ?
C'est donc bien le sulfate de plomb qui précipitera le premier etant donné que la concentration de est la plus petite ( on ajoutera beaucoup moins de
pour voir précipiter le sulfate de plomb)
Bonjour
Ton raisonnement consistant à déterminer dans les deux cas la concentration minimale en ions plomb(II) pour saturer la solution me semble bon ; je pense juste que tu as commis quelques étourderies dans l'utilisation de l'éditeur de formule : pas évident au début mais c'est bien de s'y mettre mais les choses sont tellement plus claires !
Merci bien.
En sous question, on me demande ce qui se passerait si je changeais l'ordre des réactifs.
J'imagine qu'alors ce serait le qui serait en solution et et donc qu'on ajouterais à la burette une solution comprenant des ions
et
. Mais dans l'énonce on ne me donne aucune indication supplémentaire. Donc si on me pose la question j'imagine qu'a ce moment va changer l'ordre de précipitation. Mais comme on ne me donne pas d'info supplémentaire..J'imagine que j'ai un erlen avec une concentration 0.5M en
Lorsque je fais le calcul des concentration en
et
j'arrive à la même conclusion donc je ne sais pas ce qui cloche et si on me pose la question c'est sûr qu'il y'a quelque chose qui se passe ..
j'arrive à la même conclusion
Oui concernant les inégalités, mais il y a plus subtil ici ...
Dans le premier cas, les deux valeurs de [Pb2+]sat sont extrêmement faibles : dès la première goutte de solution de nitrate de plomb(II) ajouté les deux précipités sont susceptibles de se former mais une autre réaction peut alors se produire :
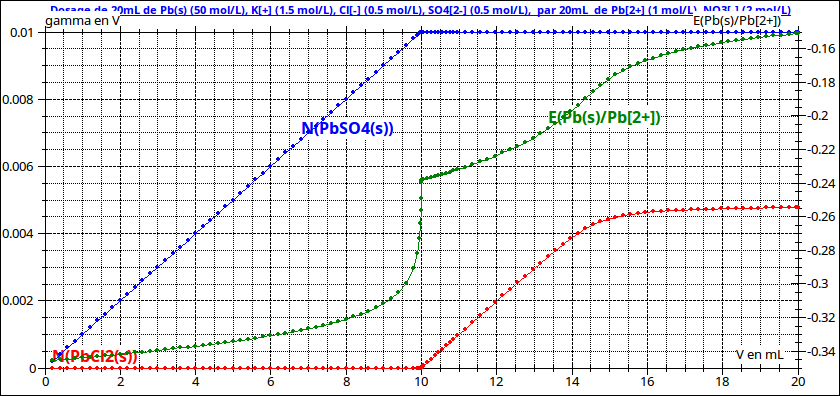
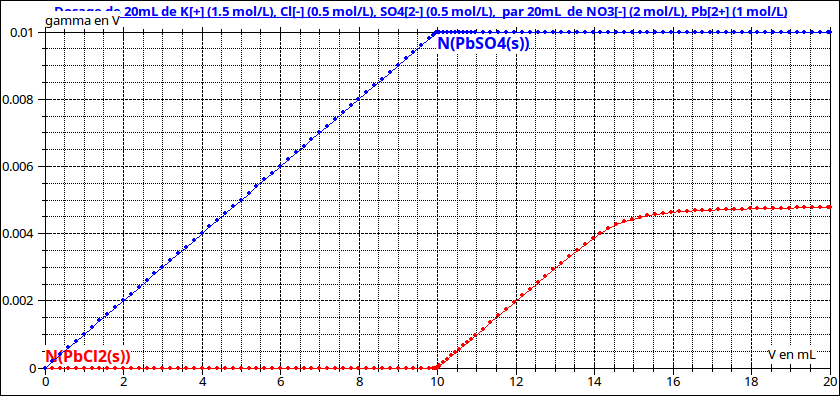
Cette réaction étant quasi totale, le précipité de chlorure de plomb ne peut pas apparaître en solution tant qu'il reste des ions sulfate en solution. Une fois les ions sulfate disparus par précipitation, le précipité de chlorure de plomb se forme à son tour : les deux réactions de précipitation sont successives. (voir première simulation)
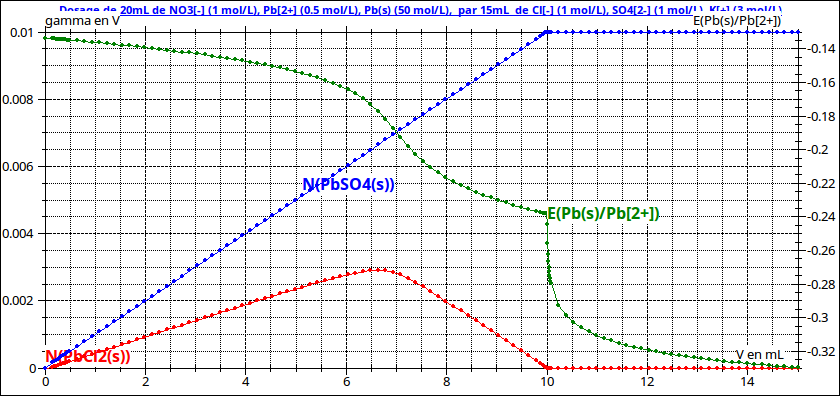
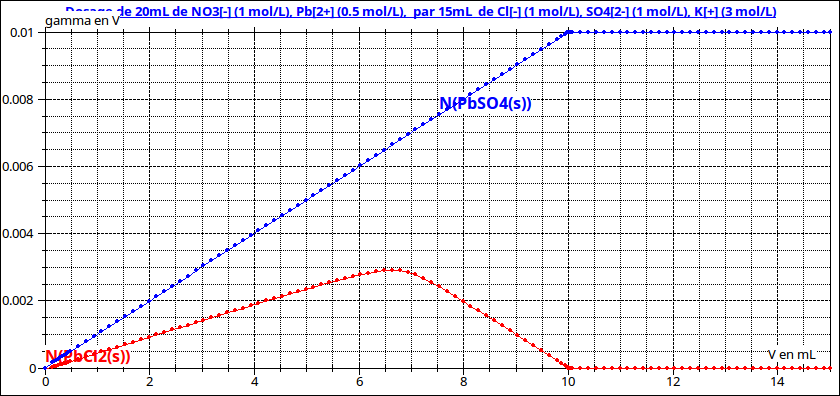
Si on inverse les réactifs, là encore les deux précipités peuvent apparaître dès un très faible ajout de mélange (sulfate, chlorure) mais, puisque, pour un faible volume ajouté, tous les ions sulfate précipitent, la réaction décrite ci-dessus ne peut pas se produire : les deux précipités apparaissent simultanément dans le mélange. Si on continue à ajouter du mélange (sulfate- chlorure) des ions sulfate deviennent disponibles pour entraîner la disparition du chlorure de plomb ; au final , si la quantité de mélange (sulfate-chlorure) ajouté est suffisante, le milieu réactionnel ne contient comme solide que du sulfate de plomb (voir simulation n° 2).
Cet exercice est plus subtil qu'il n'en a l'air au départ !
Remarque sur les courbes : l'axe des cordonnées correspond aux quantités de précipités présentes. L'indication "gamma en V" est une erreur due au fait que j'avais d'abord superposé à ces courbes celle représentant les variations de conductivité...
Les réactions peuvent être suivies par potentiométrie en plongeant dans la solution une électrode de plomb et une électrode référence (au calomel saturé par exemple). La différence de potentiel ainsi mesurée est représentée ci-dessous en fonction du volume ajouté.
Je te rappelle qu'à 25°C :