Inscription / Connexion Nouveau Sujet
Pompe à chaleur - condensation
Bonjour,
Mon diplôme d'ingénieur remonte à quelques dizaines d'années... et j'aimais pourtant bien la thermodynamique !
Mais je viens d'installer une pompe à chaleur air/eau chez moi, et je voudrais bien en comprendre le fonctionnement.
Quand le caloporteur arrive dans la pompe à chaleur (dehors, donc), je comprends qu'il arrive à l'état liquide basse pression (combien ?). Comme il a un point d'ébullition très bas (combien ?), il s'évapore sous l'effet de l'air ambiant en "pompant" les calories de celui-ci. Très bien.
Ensuite, il est comprimé, donc s'échauffe, et le moniteur affiche une température de 70°C à l'entrée du condenseur, sous une pression de 3.2 bars. OK.
Après, c'est là je ne pige plus : que la température du caloporteur baisse par échange avec l'eau domestique, OK. Mais pourquoi donc en plus se condense-t-il ? Ce qui nous arrange bien pour récupérer la chaleur latente de liquéfaction au point T,P considéré.
Merci pour vos lumières.
Bonjour
La vapeur sèche sortant du compresseur subit dans le condenseur une évolution à pression constante. Cette vapeur se refroidit jusqu'à atteindre la température d'équilibre liquide vapeur à cette pression. Alors elle se liquéfie toujours à pression constante.
Un peu plus de détails par rapport au message précédent :
Mais pourquoi donc en plus se condense-t-il ?
Le fluide caloporteur du condensateur est en contact thermique avec un milieu extérieur plus froid. Il doit donc céder de la chaleur à ce milieu plus froid : d'abord en se refroidissant mais il ne faut pas oublier que la pression dans le condenseur est maintenue constante. Dès que la température atteint la température d'équilibre liquide-vapeur à cette pression, la température ne varie pas tant que la vapeur coexiste avec le liquide. Le fluide caloporteur cède alors de la chaleur au milieu extérieur par liquéfaction à température constante. C'est ce qui fait l'intérêt du dispositif : à masse de fluide donnée, les transferts thermiques par changements d'état sont nettement plus importants que ceux obtenus par variations de température.
Je ne sais pas si tu te souviens de la notion de variance... Si on maintient la pression fixe, la coexistence du fluide pur sous deux phases n'est possible qu'à une température donnée qui dépend de la nature du fluide et de la pression imposée. Exemple bien connue : l'eau pure, sous la pression normale (1013mbar) est à l'équilibre liquide-vapeur à 100°C.
Bonjour, et merci.
Si je comprends bien, la caractéristique d'un caloporteur est qu'il se vaporise à la température de l'air quand il est détendu (environ 1 bar ?), et qu'il se condense à une température supérieure à celle de l'eau chaude qu'il produit, à la pression à laquelle il a été comprimé. Correct ?
Et comme la liquéfaction se produit à une température supérieure à celle de l'évaporation, donc plus proche du point critique, la chaleur latente libérée pour le chauffage est moindre que celle absorbée pour l'évaporation. Correct ?
Pour conclure, la technologie repose beaucoup sur les propriétés physiques des caloporteurs, lesquelles permettent de jouer avec évaporation/condensation.
Tu fais parfois référence aux caractéristiques de l'air... Le fluide caloporteur circule en circuit fermé étanche en décrivant un cycle. Les pressions d'entrée (P1) et de sortie (P2) du compresseur peuvent être choisies sans référence directe à la pression atmosphérique, sachant tout de même que de trop gros écarts à celle-ci rend les contraintes d'étanchéités plus complexes.
P2 est choisie de sorte que T2 : température d'équilibre liquide-vapeur à P2 soit un peu supérieure à la température du fluide à réchauffer (liquide circulant dans le plancher de la maison, air de la maison,...) pour que le fluide puisse céder de la chaleur au fluide caloporteur dans le condenseur.
P1 est choisie de sorte que T1, température d'équilibre liquide-vapeur à P1 soit un peu inférieure à la température du milieu extérieur ( air froid l'hiver, terre si pompe géothermique...) ; ainsi ce milieu extérieur peut fournir de la chaleur au fluide caloporteur dans l'évaporateur.
Voici un document décrivant le cycle thermodynamique commun à la pompe à chaleur et au réfrigérateur :
![]()
Histoire de te rappeler tes études de thermo, voici une fiche que j'ai élaborée il y a quelque temps sur le principe des cycles thermodynamiques : paragraphe 8.3.3 en particulier :
![]()
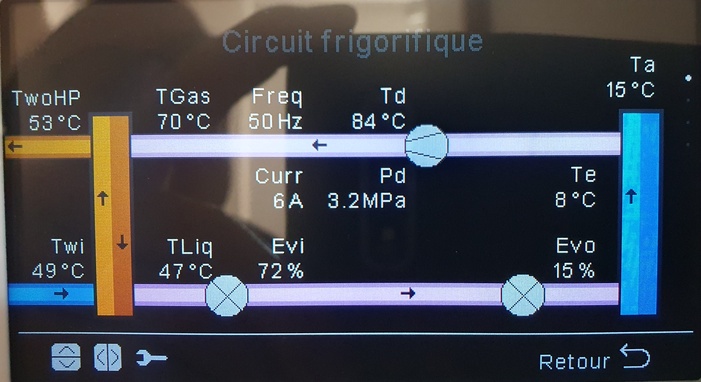
Merci, çà devient clair, et réchauffe mes souvenirs de thermo d'il y a... 35 ans ! J'ai trouvé le point d'ébullition du difluorométhane R32 : -52°C (sous 1 atm, je présume). Je comprends qu'il s'évapore même par -14°C (mini enregistré chez moi dans les Hautes Alpes). Ce matin, le compresseur indiquait 70°C et 3.2 Mpa, soit 32 bars si je me rappelle bien. Resterait à connaître le point d'ébullition à cette pression. Je présume qu'il donc être de l'ordre de 60°C .
la thermo, c'était il y a 45 ans..
Tout de même... N'hésite pas à poser des questions complémentaires si tu le juges utile.

La pression P2=32bar correspond à une température de saturation T2=51°C environ. La température de sortie étant supérieure à T2, le fluide est, comme déjà dit, à l'état de vapeur sèche (vapeur seule). Dans le condenseur, cette vapeur va se refroidir jusqu'à T2 puis se liquéfier totalement à température fixe T2 et pression fixe P2 jusqu'à entrer dans le détendeur où elle subit une détente quasi adiabatique jusqu'à la pression P1. Cette détente s'accompagne d'un début de vaporisation. Elle entre alors dans l'évaporateur où l'apport de chaleur fournie par le milieu extérieur permet la vaporisation complète à P1 fixe et T1 fixe. La vapeur entre alors dans le compresseur et un nouveau cycle se lance...
Bonjour,
et merci pour les liens envoyés plus haut. Le premier est tout à fait clair. J'ai passé l'âge pour le second...
J'y ai trouvé la réponse à une question que je me posais : la détente est pilotée pour que çà tourne aux T/P qui vont bien dans l'évaporateur. D'ailleurs, sur ma PAC, je constate qu'il y apparemment 2 détendeurs, qu'ils appellent Evi et Evo (intérieur et extérieur), et que la notice en français appelle curieusement "soupape de sécurité" ?
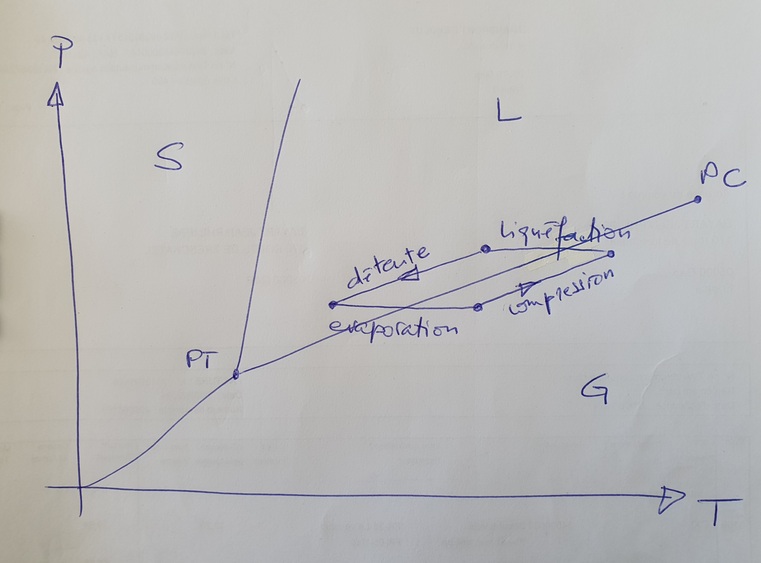
Une question sur le diagramme de Mollier : dans le centre du fer à cheval, les deux états liquide et gazeux coexistent. A droite, c'est gazeux, à gauche, c'est liquide. Du coup, je présume que le sommet du fer à cheval correspond au point critique où les deux états ne font plus qu'un, avec une chaleur latente nulle. Correct ?
Merci.
Bonjour
Tu parles je pense du diagramme de Mollier (P,h) dit "diagramme des frigoristes" car il y a de nombreux diagrammes de Mollier adaptés à diverses utilisations.
Du coup, je présume que le sommet du fer à cheval correspond au point critique où les deux états ne font plus qu'un, avec une chaleur latente nulle. Correct ?
Oui ! (On dit plutôt sommet de la courbe de saturation mais ta phrase est tout à fait compréhensible !
 )
)
Plus de renseignement ici :


