Inscription / Connexion Nouveau Sujet
PH d'une solution tampon
Bonsoir,
Je vous présente mon énoncé,
On a 0.002 moles de Na3PO4 de volume 60ml. On y ajoute 15ml de HCL à 0.2M.
Et on cherche le pH de la solution tampon.
Je sais que la formule pour trouver le pH d'uns solution tampon est donné par :
pH=pka+log (Cb/Ca)
Ici: Ca=0.2M (HCL)
Cb= n*V=1.2*10^-4 (Na3PO4)
Et pour le pKa, je prends le pka de PO4^3- soit 12.4
C'est là que je pense faire une erreur (en choisissant cette valeur de pka), j'obtiens du coups un pH de 9.178.
Or, il me semble, que je devrais trouver un Ph de 7.2
Quelles sont mes erreurs qui font que je n'arrive pas au bon résultat?
En vous remerciant, par avance
Niv bac +1: dans le paramédical
Bonsoir,
Quels sont les couples acide/base susceptibles d'intervenir ici et que valent leurs pKa ?Quelle quantité (en mole) d'acide introduit-on ?
Compare cette quantité à la quantité initiale de PO43- .
Quelle(s) est (ou quelles sont) la (ou les) réaction(s) qui s'est produite (ou se sont produites )?
Après avoir répondu à toutes ces questions, tu devrais y voir plus clair !
La physique et la chimie ne se résument pas à un catalogue de formules ; il faut réfléchir !
Merci pour votre rapide réponse.
Les couples acides/ bases qui interviennent sont:
Pour l'acide fort: HCl/ Cl- donc son pka est très faible
Pour la base: HPO4^2-/PO4^3- avec un pka de 12.4
On introduit n=C/V=0.2*15*10^-3=3.10^-3 mol d'acide donc de HCl.
Compare cette quantité à la quantité initiale de PO43- .?
Initialement, il y avait 0 mole de PO43- car on a la reaction suivante:
Na3PO4 + HCl --> NaCl + PO4 + H2O
H3PO4 est un triacide ; tu as donc 3 couples envisageables et je me demande si le pKa de l'un d'eux n'est pas, (je dis cela au hasard ), égal à 7,2 ...
), égal à 7,2 ...
Comment arrive t'on a déterminer que c'est ce pKa qu'on utilise?
Et ensuite pour le pH, j'utilise pas la formule alors, seulement le fait que pH=pKa?
Je ne sais pas si cela va t'aider ou au contraire t'embrouiller. Voici ce qui se passe quand on ajoute progressivement de l'acide chlorhydrique à la solution initiale de Na3PO4. Tu peux suivre l'évolution du pH et aussi les évolutions des différentes concentrations. Tu vas bien sûr devoir t'intéresser particulièrement au cas particulier v=15mL
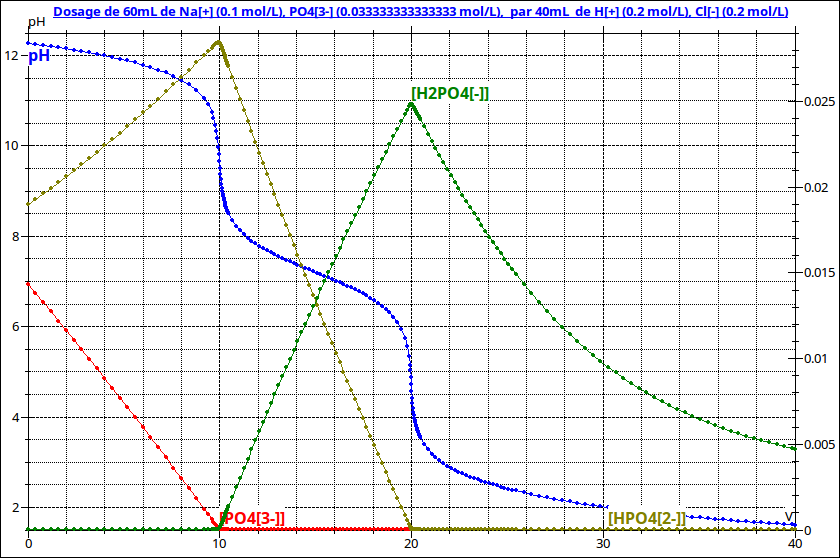
Voici les trois couples et leurs pKa :
H3PO4/H2PO4- : pKa1=2,2
H2PO4-/HPO42- : pKa2 = 7,2
HPO4-2/PO43- : pKa3=12,3
Je comprends bien graphiquement.
Mais sans le graphique, je comprends toujours pas pourquoi on prends ce couple avec ce pka, qui corresponds au 2eme saut.
Avec un indicateur coloré préciser, j'aurais su déterminer le pka en question.
Bonsoir,
La première réaction entre l'acide chlorhydrique et les ions phosphate est :
Sa constante d'équilibre est :
La réaction peut être considérée comme totale ; d'où le tableau d'avancement :
Les ions hydrogénophosphates créés peuvent réagir sur les ions oxonium restants selon la réaction :
Sa constante d'équilibre est :
La réaction peut être considérée comme totale, d'où le tableau d'avancement :
L'état final correspond à la demie équivalence : 50% des ions hydrogénophosphates ont réagit ; les ions hydrogénophosphate et dihydrogénophosphate sont en quantités égales. Pour un couple acide/base donné, on peut écrire :
L'expression ne dépend pas directement des concentrations mais seulement du fait que l'acide et sa base conjuguées ont la même concentration. Le pH de la solution sera donc très peu sensible à un ajout d'eau (une dilution)
La courbe pH = f(v) montre que le pH varie peu en fonction du volume d'acide ajouté au voisinage de la demie-équivalence.
Une solution qui à ces deux propriétés :
1 : avoir un pH très peu sensible à la dilution ;
2 : avoir un pH peu sensible à l'ajout d'une petite quantité d'acide ou de base ;
peut être qualifiée de solution tampon.


