Inscription / Connexion Nouveau Sujet
pH acide a aminé
Bonsoir !
Quelques questions concernant l'étude d'un acide  aminé (l'aniline)
aminé (l'aniline)
-Comment sait on que c'est le pKa du COH qui vaut 2.3 et celui du NH3 qui vaut 9.7 ?
-Sur le dessin, comment sait - on que le zwitterion est la forme entourée et pas l'autre ?
-Enfin, comment cacluler le pH d'une solution d'aniline à 0.10mol/L ? L'utilisation de la formule des acides ou des bases faibles pose soucis , et nous avons 2 pKa
Merci d'avance pour votre aide 
Bonne soirée !
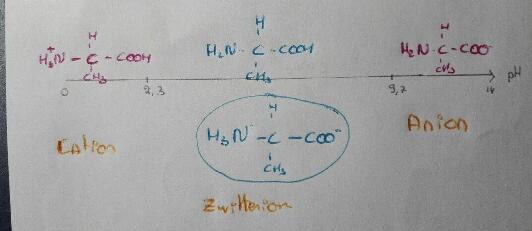
En ayant fait des recherches sur internet, il était mentionné que le pH d'une solution d'acides aminés ( des charges nulle) est pHi = 0.5(pKa
des charges nulle) est pHi = 0.5(pKa + pKa
)
Cette formule ne prend pas en compte la concentration
Est-ce celle là qu'il faut utiliser ?
Bonne soirée !
Bonsoir
Comment sait on que c'est le pKa du COOH qui vaut 2.3 et celui du NH2 qui vaut 9.7 ?
La force d'un acide ou d'une base (donc le pKa) dépend beaucoup du groupement fonctionnel et un peu de la structure du reste de la molécule ou de l'ion.
Tu dois savoir que les acides carboxyliques (acide méthanoïque, éthanoïque...) ont des pKa de l'ordre de 3 - 4 ; tu dois aussi savoir que l'ammoniac NH3 a un pKa de 9,2... Donc ...
Sur le dessin, comment sait - on que le zwitterion est la forme entourée et pas l'autre ?
Par définition, le zwitterion est une espèce moléculaire polarisée mais électriquement neûtre obtenu par migration d'un ion H+ du groupement -COOH vers le groupement -NH2. Le zwitterion possède donc un -COO- et un -NH3+.
Est-ce celle là qu'il faut utiliser ?
Le pH se calcule comme celui d'une espèce amphotère : l'eau pure par exemple : le pH est la moyenne des deux pKa. (pour l'eau la moyenne de 0 et 14 donne bien 7).
Tu trouveras une démonstration rigoureuse ici au paragraphe II.3.g :


