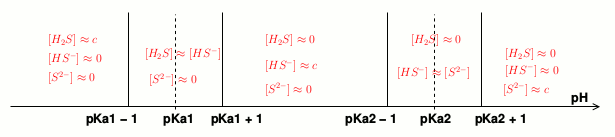Inscription / Connexion Nouveau Sujet
pH
Bonsoir à tous,
Je commence des exercices sur les pH et les réactions acido-basiques.
Je rencontre une difficulté dans la compréhension d'un exercice, et la détermination de pH.
Voici l'énoncé:
"Soit 0,1L d'une solution A contenant 182,5 mg d'HCl dans de l'eau pure
Soit 0,1L d'une solution B contenant 150 mg de CH3COOH dans de l'eau pure
et soit une solution C obtenue en mélangeant des volumes égaux de A et de B
Calculer le pH de chacune des 3 solutions A, B et C
Ka (CH3COOH) = 10⁻4,76
M(H) = 1, M(C)=12, M(O)= 16 et M(Cl)=35,5"
Pour commencer il semble judicieux de déterminer les quantités de matière et concentrations de chacune des solutions.
Dans la solution A,
n = C.V soit m/M = C.V soit C =m/(M.V)
C(HCl) = 0,1825/(36,5x0,1) = 0,05mol/L
n(HCl) = 0,05 x 0,1 = 0,005 mol
Dans la solution B,
C(CH3COOH) = 0,15/(60x0,1) = 0,025 mol/L
n(CH3COOH) = 0,025 x 0,1 = 0,0025 mol
Dans la solution C, je suppose prendre la totalité du volume de chaque solution A et B soit 0,1 x 2 = 0,2 L
La quantité de matière dans la solution C est donc égale à n(HCl) + n(CH3COOH) = 0,005 + 0,0025 = 0,0075 mol
Ainsi la C(C) = 0,0075/0,2 = 0,0375 mol/L
Ensuite nous savons qu'HCl est un acide fort, nous devons donc simplement appliqué la formule du pH = -logC
pH(HCl)= 1,3
Par ailleurs nous connaissons le Ka(CH3COOH) = 10⁻4,76 soit un pKa = 4,76 (et un pKb de la base conjuguée = 9,24) soit pKa < pKb soit un pKa faible donc un acide fort.
Nous en déduisons que CH3COOH est un acide fort.
De ce fait nous pouvons utiliser à nouveau la formule précédente:
pH = -logC
pH(CH3COOH) = 1,6
Pour poursuivre, nous connaissons la concentration de la solution finale C = 0,0375 mol/L
Nous pouvons cependant utiliser la formule de calcul de pH pour un mélange d'électrolyte, dans ce cas, nous ne retenons que la concentration de l'acide fort.
Or il me semble que HCl est l'acide le plus fort (juste une supposition, puisqu'il est connu qu'HCl est un acide fort) donc je ne suis certaine du calcul (c'est d'ailleurs pourquoi je poste ce message).
De ce fait, pH(solutionC) = -logC(HCl) = 1,3
Je ne suis pas du tout certaine pour la détermination des 2 derniers pH.
Quelqu'un aurait la gentillesse de m'aiguiller?
Merci par avance
Mimi
Bonsoir
D'accord avec toi pour ce qui concerne l'acide chlorhydrique.
En revanche, l'acide éthanoïque est un acide faible ; sinon on ne fournirait pas de pKa ou alors un pKa théorique négatif...
Tu peux tenter de calculer le pH en supposant l'acide très peu dissocié dans l'eau ; alors :
Tu vérifie que la valeur obtenue est cohérente avec les hypothèses simplificatrices conduisant à cette formule.
Pour le mélange acide fort - acide faible, tu peux tenter l'hypothèse d'un acide faible extrêmement peu dissocié de sorte que le pH soit imposé par l'acide fort seul. C'est ce que tu as fait mais il faut vérifier ensuite que le résultat est cohérent avec cette hypothèse simplificatrice.
Bonjour
Merci Vanoise,
je ne comprends pas pourquoi CH3COOH est un acide faible puis le Ka = 10⁻4,76 soit un pKa = 4,76 de ce fait le pKb (base conjuguée) = 9,24.
Ainsi le pKa < pKb, ce qui est la définition d'un acide fort (le pKa est faible, plus le Ka est élevé et donc plus l'acide est fort). Est ce possible d'avoir un éclairement sur mon raisonnement qui semble erroné?
Donc si je me base sur votre raisonnement Vanoise, je trouve pH = 3,18
Ensuite pour la solution C.
Je suppose donc que le pH est imposé par l'acide fort: HCl
Soit pH = -logC(HCl) = 1,3
Je ne comprends néanmoins pas ce que vous voulez dire: "C'est ce que tu as fait mais il faut vérifier ensuite que le résultat est cohérent avec cette hypothèse simplificatrice".
Soit la premiere réaction A: CH3COOH + H2O ---> CH3COO⁻ + H3O⁺
Ka1 = [CH3COO-][H3O⁺]/[CH3COOH]
Soit la deuxième réaction B: HCl + H2O ---> Cl⁻ + H3O⁺
Ka2 = [Cl⁻][H3O⁺]/[HCl]
Soit la troisième réaction C: CH3COOH + HCl + 2H2O ---> Cl⁻ + CH3COO⁻ + 2H3O⁺
Ka3 = [Cl⁻][CH3COO⁻][H3O⁺]² / [CH3COOH][HCl][H2O]²
Soit Ka3 = Ka1 x Ka2
Je ne sais pas si ce raisonnement est très utile pour la résolution de l'exercice.
Car je suis bloquée pour la suite :/
Merci par avance
Mimi
Ainsi le pKa < pKb, ce qui est la définition d'un acide fort
Où es-tu allé chercher cela ???
Un acide est fort quand il réagit de façon totale sur l'eau ; exemple : le chlorure d'hydrogène :
HCl + H2O
 H30+ + Cl-
H30+ + Cl-
Une base est forte quand elle réagit de façon totale sur l'eau ; exemple : l'ion éthanolate :
CH3CH2O- +H2O
 CH3CH2OH + HO-
CH3CH2OH + HO-
On considère aussi comme base forte les hydroxyde métallique qui se dissocie de façon totale dans l'eau :
NaOH(s)
 Na+ + HO-
Na+ + HO-
l'inégalité ci-dessus, signifie seulement que, pour un acide faible donné et sa base conjuguée (base faible), le taux de réaction sur l'eau de l'acide est plus important que le taux de réaction sur l'eau de la base conjuguée, à quantités introduites par litre identiques. Exemple : pour une même concentration, le taux de réaction sur l'eau de l'acide éthanoïque est plus élevé que le taux de réaction sur l'eau de l'ion éthanoate.
Pour le mélange des deux acides, la vérification de l'hypothèse se fait en une ligne si tu as bien compris la notion de domaine de prédominance. Il suffit de vérifier :
pH <( pKa - 1)
D'accord merci Vanoise,
effectivement j'étais à "côté de la plaque".
En fait je faisais une grossière confusion.
Finalement l'inégalité n'est vrai que pour un couple acide/base donné et donc inappropriée pour déterminer le caractère acide ou basique d'une espèce.
Je n'ai cependant pas compris de ce fait pourquoi affirmez vous que CH3COOH est un acide faible. Car nous avons sa concentration, le pKa mais nous ne connaissons pas le pH (qui est à déterminer) donc possibilité de déterminer l'acidité ou la basicité de CH3COOH après les calculs.
Je suis un peu perdue.
Je pense peut-être avoir compris
Soit la réaction
CH3COOH + H2O--> CH3COO⁻ + H3O⁺
2H2O ---> H3O⁺ + OH⁻
Si nous supposons x = [H3O⁺]
x = [CH3COO⁻] + [OH⁻]
x = 0,025 + 1O⁻14/x
x² - 0,025x - 10⁻14 = 0
Delta = 0,000625
et donc x = 0,025 mol/L = [H3O⁺]
pH= -log(0,025) = 1,6
pKa = 4,76 soit pKa-1 = 3,76 nous vérifions bien pH < (pKa-1)
Est ce correct?
Non !
1° : tu peux négliger l'autoprotolyse de l'eau ; cette simplification est valide si le pH obtenu n'est pas trop près de 7 : inférieur à 6,5 pour une solution acide, supérieur à 7,5 pour une solution basique.
2° le tableau d'avancement conduit à :
[H30+]=[CH3CO2-]=x
[CH3CO2H]=c-x c si l'acide est très peu dissocié. Le raisonnement sur les domaines de prédominance montre que l'hypothèse est vérifiée sous réserve que pH < (pKa - 1).
c si l'acide est très peu dissocié. Le raisonnement sur les domaines de prédominance montre que l'hypothèse est vérifiée sous réserve que pH < (pKa - 1).
Je te laisse achever le calcul ; il conduit à une formule très classique :
Résultat cohérent avec les deux hypothèses simplificatrices.
Merci Vanoise pour votre réponse.
Je pensais avoir compris jusqu'à ce que vous venez d'écrire "Le raisonnement sur les domaines de prédominance montre que l'hypothèse est vérifiée sous réserve que pH < (pKa - 1)".
Qu'as-tu compris (ou pas compris) concernant les domaines de prédominance ? Il s'agit d'un outils extrêmement précieux pour choisir des hypothèses simplificatrices puis valider la pertinence de ces hypothèses.
Dans l'exercice on demande de calculer le pH d'une solution de 0,1L contenant 150 mg de CH3COOH dans de l'eau pure .
A partir de cet énoncé, dans un tout premier temps, comment parvenez-vous à affirmer que CH3COOH est un acide faible en connaissant simplement le Ka (10⁻4,76) et sans connaitre le pH puisque c'est ce qu'on nous demande?
Merci 
Pour le domaine de prédominance,
je comprends que si le pH<pKa alors la forme basique prédomine puisque pH = pKa + log([A⁻]/[AH])
et que si pH > pKa alors la forme acide prédomine.
et par définition si pH = pKa alors les deux espèces sont en concentrations égales.
Bonjour
Ce que tu as écrit dans ton message du 03-12-17 à 20:00 est tout à fait exact. On peut cependant aller un peu plus loin dans l'application de la formule :
Si on cherche à déterminer le pH avec une erreur ne dépassant pas 0,1 unité, on peut faire l'approximation suivante : dans une somme de deux concentrations, on peut négliger la plus faible des deux si elle est au moins dix fois plus petite que l'autre. Si on note c la quantité d'acide ou de base introduite par litre de solution, la conservation de la matière lors de la réaction sur l'eau conduit à :
c=[AH]+[A-]
On considérera donc l'acide comme très peu dissocié en posant [AH] c si [AH]>10[A-], soit, en utilisant la formule rappelée ci-dessus, si pH<(pKa - 1)
c si [AH]>10[A-], soit, en utilisant la formule rappelée ci-dessus, si pH<(pKa - 1)
Inversement, on considérera la base comme très peu dissociée en posant [A-] c si [A-]>10[AH], soit si pH>(pKa + 1).
c si [A-]>10[AH], soit si pH>(pKa + 1).
Pour résumer : on tient compte dans les calculs des deux concentrations en acide et en base conjuguée seulement pour pH compris entre (pKa - 1) et (pKa+1).
Raisonnement analogue pour l'autoprotolyse de l'eau. Dans une solution acide, son influence est négligeable si [H3O+]>10[HO-]. En multipliant chaque terme par [H3O+] :
[H3O+]2 > 10[H3O+].[HO-]
soit :
[H3O+]2 >10-13 à 25°C
soit pH<6,5.
Dans une solution basique, on peut négliger l'influence de l'autoprotolyse de l'eau si :
[HO-]>10[H3O+]
Je te laisse démontrer que cela conduit à : pH >7,5.
En pratique : on peut négliger l'autoprotolyse de l'eau dans un calcul à condition que le pH soit inférieur à 6,5 ou supérieur à 7,5.