Inscription / Connexion Nouveau Sujet
Nombre d'oxydation
Bonjour à tous.
Question : Trouver le nombre d'oxydation de chaque carbone composant les molécules.
Réponse en pièce jointe.
Serait-il possible de me dire si ma réponse est correcte s'il vous plait ?

PDF - 15 Ko
Bonjour
D'accord avec toi pour la molécule d'alcool mais je ne comprends pas le +IV du carbone de la fonction ester. Tu peux expliquer ton raisonnement ?
Complément à mon premier message : à propos de la molécule d'ester, revois aussi le cas du deuxième carbone à partir de la droite...
Ce n'est pas tout à fait cela. Je te rappelle la définition du n.o. et ces conséquences.
Le nombre d'oxydation d'un élément est la charge fictive que prendrait l'atome de cet élément si toutes les liaisons covalentes se coupaient en tenant compte de leur état de polarisation.
Conséquences :
*si une liaison entre deux atomes identiques se coupe, chaque atome récupère son électron : une telle liaison contribue pour "zéro" au nombre d'oxydation. Cela va être le cas ici pour les liaisons C-C et plus généralement, c'est le cas pour les atomes de corps simples (no de H dans H2 vaut zéro).
*si une liaison entre deux atomes différents se coupe (fictivement), l'atome le plus électronégatif récupère les deux électrons ; cette rupture de liaison augmente de 1 le n.o. de l'atome le moins électronégatif et diminue de 1 le n.o. de l'atome le plus électronégatif. Ici : l'élément O est le plus électronégatif et est toujours lié par 2 liaisons. Son n.o. vaut toujours -II. Ce n'est pas le cas dans les peroxydes (H2O2 par exemple) où son n.o. vaut -I.
C étant un peu plus électronégatif que H. La rupture fictive d'une liaison O-H ou d'une liaison C-H conduit à un n.o. de H égal à +I et diminue de 1 le n.o. de C ou de O. Sauf dans H2 (no=0) et dans les hydrure métallique (Li-H par exemple) où le no de H vaut -I, le no de H vaut +I.
Donc ici : pour tous les atomes H : no=+I ;
pour tous les atomes O : no=-II
pour les atomes C, cela varie d'un atome à l'autre. Envisage la rupture fictive une à une des quatre liaisons et vois pour chacune la variation de no de C que cette rupture fictive entraîne.
En absence d'erreur, la somme algébrique des no doit être égale à la charge totale de la structure, donc égale à zéro pour une molécule.
La réponse serait donc celle-ci ? On a bien un nombre d'oxydation de -II pour chaque Oxygène et +I pour chaque Hydrogène. Et le nombre d'oxydation totale vaut 0.

PDF - 12 Ko
Voici une illustration de la méthode que j'ai décrite dans mon précédent message appliquée à la moitié droite (sur ton schéma) de la molécule d'ester. Il n'y a pas d'erreur pour la moitié gauche. Les nombres d'oxydation des atomes O et C sont indiqués en bleu. Je ne l'ai pas indiqué sur le schéma mais tu sais bien que tous les atomes H ont pour n.o. +I.
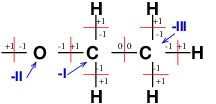
Vous avez dit que la somme algébrique des no doit être égale à la charge totale de la structure. Ici c'est 0. Mais en faisant la somme de tous les no de chaque atome, on trouve 1 d'après votre schéma. Je ne comprends pas.
Tu n'as pas vraiment compris la méthode et j'aurais sans doute dû étudier la totalité de la molécule. Je reprends ta réponse du 27-03-25 à 17:25 , pas la dernière . Toute la moitié gauche était bonne. Les deux modifications à apporter concernent :
1° : -O- qui est à -II puisque ses deux liaisons sont polarisées avec C moins électronégatif que C.
2° : Le deuxième C à partir de la droite est à -I plutôt qu'à -II comme justifié dans mon message précédent. Entraîne toi à retrouver tout cela à partir des liaisons polarisées ou non.
N'hésite pas à faire d'autres exercices que tu peux éventuellement poster ici.
Je me suis mal relu :
-O- qui est à -II puisque ses deux liaisons sont polarisées avec C moins électronégatif que O.
J'ai détaillé la méthode sur les 2 molécules. Est-ce que c'est correct ?

PDF - 16 Ko


