Inscription / Connexion Nouveau Sujet
Monoacide/ notion de Ka et pH
Bonjour, voici mon dernier exercice sur lequel je suis tombé à ma partiel de chimie. Contrairement celui-ci m'a autant inspiré :/. J'aurais alors besoin de plusieurs cerveaux pour m'aider à le résoudre ^^.
Ma signature : Merci d'avance de votre aide.
Voici l'énoncé :
On considère 0,1 L d'une solution de NaHSo4 de concentration 0,1 mol/L. Ce composé est totalement ionisé en solution aqueuse en ions Na+ et HSO4-.L'ion HSO4- se comporte dans l'eau comme un monoacide faible.
1. Ecrire les deux équations bilan consécutives à la mise en place de NaHSO4 dans l'eau. Identifier les couples acido-basiques en préscence. Donner l'expression du Ka du couple dont l'ion HSO4- est la base conjugué.
NaHSO4 = Na++HSO4-
HSO4-+H20 = SO42- + H30+
Couples acido-basiques : HSO4-/NaHSO4 et HSO4-/SO42-
Ka =
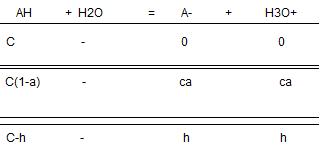
2. A l'aide d'un tableau d'avancement appliqué à l'équilibre acido-basique, établir l'expression littérale de la concentration de toutes les espèces chimiques présentes en solution en fonction de l'avancement.
Ka = h²=Ka.C
J'ai tenter de suivre un cours du net mais je pense pas que c'était une bonne idée ^^"
3. Le pH mesuré est de 2,2. En déduire les valeurs des concentrations de toutes les E.CH présentes en solution. Calculer Ka et pKa.
Grâce au pH :
[H3O+]=10-2,2.
Je sais que : pH=(pKa-log(c))
Ainsi 10-(pH.2+log(c))
4. Est ce un acide plus fort que l'acide éthanoïque (pka =4,75) à la même température?
Je pense que non car l'acide éthanoïque est un acide faible aussi.
5.Donner l'expression simplifée permettant de calculer le pH d'un acide faire HA quelque dont on connaît la concentration C0. Démontrer la formule et préciser les approximations considérées. Vérifier si cette équation est valable pour cette solution, et dans le cas contraire expliquer pourquoi.
pH=(pKa-log(c))
Comme vous aurez pu voir j'ai été beaucoup moins inspiré pour ce dernier exercice ^^"
Bonjour,
question 1 : H2O est le solvant, comme les solides, les solvants n'interviennent pas dans l'expression des constantes d'équilibres (leur activité vaut 1...)
question 2 ; HSO4- est un acide trop fort pour que l'approximation [HSO4-]>>[SO42-] soit valide. Le tableau d'avancement conduit à : Ka=h2/(c-h)
Dans ces conditions, la relation : est fausse.
Il me semble bien t'avoir déjà expliqué tout cela...
![]() Chimie dosage Acide/Bas par Ph-Métrie
Chimie dosage Acide/Bas par Ph-Métrie
Je peux me baser sur ce dernier pour la rédaction de celui-ci ?
***Raccourci url ajouté***
J'ai déjà répondu à une question analogue le 30-12-15 à 18:54 ;
Ici, le pKa du coupleHSO4-/SO42- vaut 1,9. HSO4- est un acide suffisamment fort pour que son taux de dissociation dans l'eau ne soit pas très faible... La formule approchée ne s'applique pas...
Je suis parti du fait que [SO42-] réagissait peu par rapport à [HSO4-]. De plus l'ensemble de la solution est acide donc je peux également dire que [H3O+]>>[OH-].
Du coup cela me permet de beaucoup simplifier l'expression du Ka et d'ainsi obtenir un moyen de le calculer.
Co=[HSO4-]
Ka =
[H3O+]=10-ph=10-2,2
Co = 0,01 mol.L-1
Donc ka = 6,31x10-1
pka = -log(ka) = 2,00x10-1
Plus le pKa est petit plus l'acide est fort ce qui est le cas donc cet acide est plus fort que l'acide éthanoïque.
Bonjour,
le 09-01-16 à 23:30 tu remplis correctement un tableau d'avancement qui te conduit à :
soit :
ce qui est très bien mais as-tu vraiment compris ce tableau ou l'as-tu copié sur internet ? Je me pose la question car le 10-01-16 à 15:15 tu écris :
Co=[HSO4-]
alors que le 10-01-16 à 13:06, je t'avais expliqué que l'acide HSO4- est trop fort pour que l' approximation c=[HSO4-] puisse être utilisée . De plus, l'expression de Ka est fausse !
Il faut résoudre d'équation du second degré en h résultant de la définition de Ka que je viens de réécrire en début de message et que je t'avais déjà indiquée le 10-01-16 à 13:06 ; tu verras qu'elle conduit à un pH différent de celui donné par la formule approchée :
même si l'écart n'est pas très grand : avec pKa=1,9, la méthode rigoureuse conduit à pH=1,53 alors que la formule approchée conduit à 1,45.
Je pense vraiment que tu devrais étudier sérieusement un cours structuré sur les équilibres en solution aqueuse.



