Inscription / Connexion Nouveau Sujet
l'équation de Schrödinger
Bonjour
Dans les cas suivantes :
1 - électron de l'atome d'hydrogène
2- électron d'un ion hydrogènoide de charge nucléaire Ze
3 - électron de l'ion moléculaire H+2
comment je peux distinguer l'équation de Schrödinger dans ces cas et merci .
Bonjour
Dans les trois cas, le système étudié est l'unique électron de la structure. Seule change l'expression de l'énergie potentielle électrostatique.
Si l'électron de charge (-e) est situé en un point M où le potentiel électrostatique créé par le noyau (ou les deux noyaux dans le dernier cas) est V, son énergie potentielle est (-e.V).
J'imagine logiquement que, si tu abordes l'étude de la mécanique quantique, tu as eu auparavant une étude sérieuse de l'électrostatique... Sinon...
je suis en 1er année
j'étudie actuellement l'atomisatique et ils nous étudient la structure de l'atome d'hydrogène et sa description quantique comme premier chapitre , on a étudié l'équation de Schrödinger sans aucune démonstration d'où vient elle et j'ai pas compris ce module
tout ça sans étudier l'electrostique.
c'est-à-dire je n'arrive pas à comprendre ce module maintenant ?
Pour le programme de chimie niveau bac+1, il faut essentiellement retenir la quantification de l'énergie, la notion d' orbitales atomiques et les nombres quantiques. Tu pourras revenir plus tard sur les justifications de tout cela à partir de l'équation de schrodinger.
Oui on a étudié et le nombres quantiques et les orbitales atomiques .
pouvez- vous me donner un site ou bien un pdf pour bien comprendre ces choses avec des exercices plus simples et merci d'avance ?
franchement j'ai pas trouvé ce qu'il peut m'aider , j'espère si vous pouvez me donner la formule de chaque cas et puis j'essaierai de distinguer la différence entre-eux et merci .
Tu ne m'as pas bien compris. Les deux documents que je t'ai fournis n'ont pas pour but de t'aider à résoudre ton exercice que, de toutes façons, tu ne peux pas comprendre dans la mesure où tu n'as pas étudié l'électrostatique en physique. Ces documents résume simplement l'essentiel du cours d'atomistique à connaître pour comprendre la suite du cours de chimie de niveau (bac+1).
Pour ton exercice, les trois équations de Schrödinger sont-elles fournies ?
Bon , j'ai fait une petite recherche et j'ai trouvé ça , est ce qu'on peut considérer que c vrai pour la première cas ?
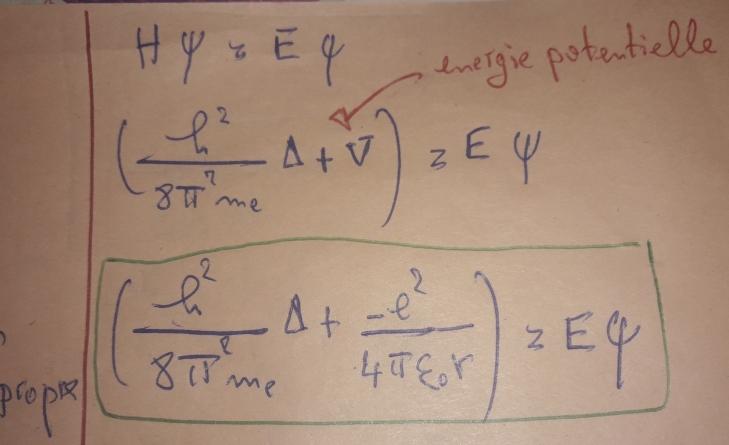
L'ex pression du potentiel créé par un noyau de charge+e (noyau d'hydrogène) est :
L'énergie potentielle d'un électron dans un tel champ est donc :
Dans le cas d'un noyau de charge +Z.e, il faut remplacer dans l'expression de V, e par Z.e
Tu dois pouvoir te débrouiller avec cela ; tu comprendras plus tard en cours d'année.
La situation que tu as scannée correspond à l'atome H ;
La situation où Ep est la valeur précédente multipliée par Z correspond à un ion hydrogénoïde : un électron et un noyau de charge Z.e
Par élimination reste la troisième dont l'expression de Ep est plus compliquée.


