Inscription / Connexion Nouveau Sujet
isomérie de configuration et chiralité
Bonjour, j'ai la correction d'un exercice mais je ne comprends pas bien, la consigne était la suivante :
Dessinez en représentation de Cram les stéréoisomères correspondant à chacune des formules semi-développés suivantes :
Voilà mes questions :
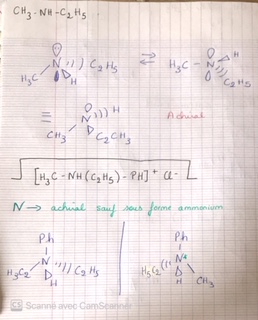
- Pour H3C-NH-C2H5 : que représente les bulles ? Je pensais aux doublets non liants mais je ne suis pas sûr, de plus il y en a un grisé et je ne vois pas pourquoi, à moins qu'il y ait un doublet non liant à l'avant et un autre à l'arrière.
- Sous forme ammonium c'est quoi ? Et comment représenter la molécule avec le Cl-, (la je ne l'ai pas écrit mais sur la correction le Cl- est placé à côté, on ne peut pas le représenter autrement ?).
- quand on a des formules semi développés comme celles-ci et que l'on doit les représenter, le placement des atomes autour de l'atome central est-il aléatoire ou non ? (lesquels placent-on à l'avant, à l'arrière, sur le plan 2D...)
- On parle de carbone asymétrique pour savoir si une molécule est chirale ou achirale, mais si l'atome centrale n'est pas un carbone mais un autre atome parle t-on de N asymétrique par exemple et cela va avoir une influence sur la chiralité ou non de la molécule ?
Cordialement, merci 
Bonjour
Je pensais aux doublets non liants
Tu penses bien. Ce doublet non liant est responsable de la géométrie pyramidale avec angles de liaisons proches de 107°, de la molécule d'ammoniac et des molécules où un ou plusieurs H est (ou sont) remplacé(s) par un (ou plusieurs) atome(s) ou radicaux. Sans ce doublet non liant, la structure serait plane avec des angles de liaisons de 102°. Revois ton cours au besoin sur la méthode VSEPR.
Sous forme ammonium c'est quoi ?
Ce doublet non liant de N peut former une liaison covalente de coordination (on dit parfois encore : liaison covalente dative) avec un ion H+ ou un ion métallique présentant une couche de valence incomplète ou vide : les deux électrons mis en commun proviennent du même atome (ici N) alors que, pour les liaisons covalentes ordinaires, chaque atome met un électron en commun pour former la liaison. La structure contenant N est alors souvent un ion positif ; pour assurer l'électro neutralité, il est accompagné d'ions négatifs, Cl- par exemple. En solution, les ions positifs et les ions négatifs sont dispersés parmi les molécules de solvant. Il est intéressant de signaler la présence de ces ions négatifs mais il n'existe pas de formalisme officiel pour les représenter.
quand on a des formules semi développés comme celles-ci et que l'on doit les représenter, le placement des atomes autour de l'atome central est-il aléatoire ou non ?
Oui ; il n'y a pas de règle particulière pour la formule semi développée. En revanche, puisque ici, N est entouré de 4 atomes ou groupement d'atomes différents, N est asymétrique, comme peut l'être parfois un atome C, et l'ion est chiral. Pour rendre compte de cela, on peut utiliser la méthode de Cram que tu as sûrement étudiée.
N'hésite pas à poser des questions complémentaires si tu le juges utile.
D'accord merci beaucoup, je n'ai pas de questions complémentaires sur cet exercice mais sur un autre. Sur les tableaux d'interprétations des spectres RMN il y a généralement une colonne "motif proposé" et "attribution", et je ne vois pas à quoi ca correspond. Je ne comprends pas ce qu'est la nature de l'orbitale contenant le doublet libre et donc comment la trouver.
Cordialement 
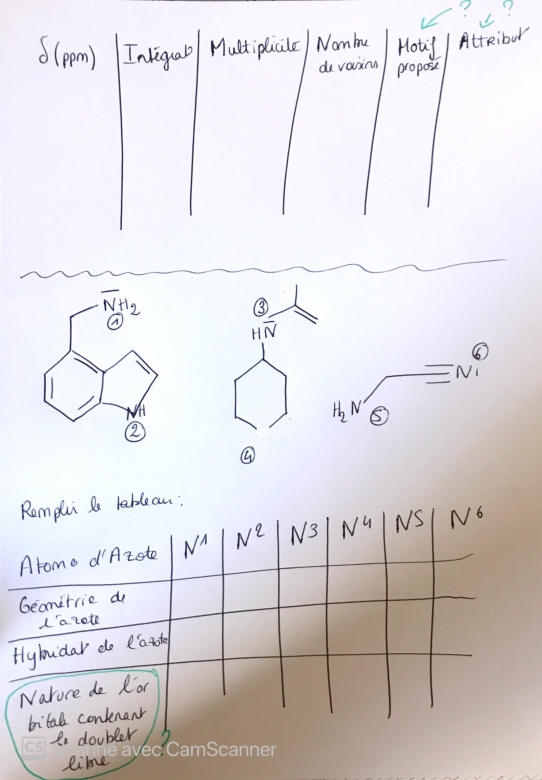
Pour tous les atomes d'azote sauf le 6, N possède un doublet de valence non liant et est lié par trois liaisons covalentes simples. Comme déjà expliqué, cela correspond à une géométrie où N est au sommet d'une pyramide avec des angles de liaison proches de 107°. Cela correspond à une hybridation de type sp3. Revois ton cours sur ce sujet si nécessaire. Le doublet non liant occupe donc une orbitale sp3.
Pour le radical CN (cas n° 6) : il y a hybridation sp caractéristique des angles de liaisons de 180°.
Un électron de N de l'orbitale sp se lie à un électron de C d'une orbitale sp pour former une liaison covalente  . Deux électrons de N occupant les orbitales px et py forment deux liaisons
. Deux électrons de N occupant les orbitales px et py forment deux liaisons  avec deux électrons de C. Le doublet non liant de N occupe donc la seconde orbitale sp de N.
avec deux électrons de C. Le doublet non liant de N occupe donc la seconde orbitale sp de N.
Merci, et pour le "motif proposé" et "attribution" du RMN savez vous a quoi cela correspond ?
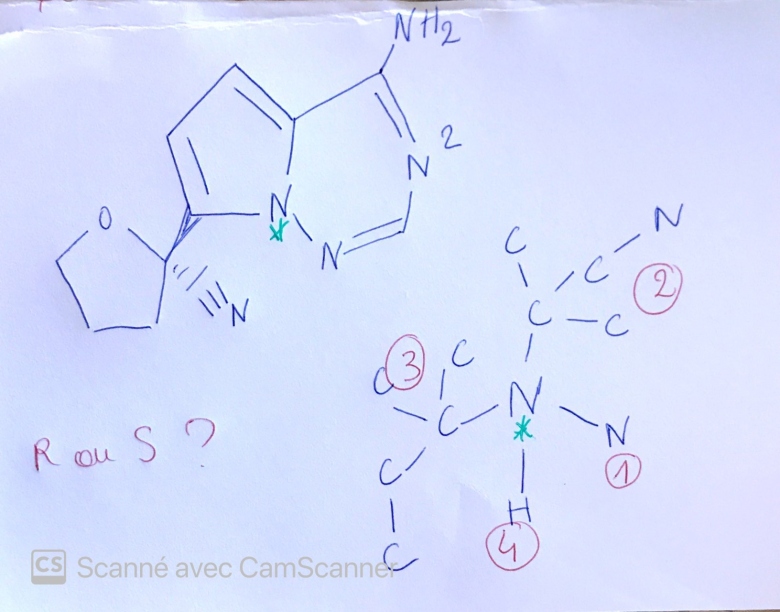
oui il faut vraiment que je relise mon cours. J'ai une autre question pour les configurations S et R, je sais qu'il faut inverser le sens quand on a le substituant 4 a l'avant et non à l'arrière mais quand les molécules sont dessinées ce n'est pas toujours indiqué quand un atome/ groupe d'atomes est à l'avant où à l'arrière : comme ici :