Inscription / Connexion Nouveau Sujet
Influence d'une réaction de complexation sur un dosage redox
Bonjour, je bloques sur un exercice de chimie, voici l'énoncé:
Données :
EECS - EESH = 0,25 V.
ECS : électrode au calomel saturée
ESH : électrode standard à hydrogène
E° (Co3+/Co2+) = 1,84V
E° (Ce4+/Ce3+) = 1,44 V
E° (Fe3+/Fe2+) = 0,77 V
pKs (Fe(OH)3 = 38
pKs (Co(OH)2 = 14
La solution étudiée est constituée d'un mélange d'ions fer (II) Fe2+ et d'ions cobalt (II) Co2+ (solution A).
On effectue d'abord un titrage de cette solution par une solution d'ions cérium (IV) Ce4+ de concentration 1,00.10-2 mol.L-1 (solution B) en milieu acide, puis un second titrage en présence d'un ligand azoté l'orthophénanthroline noté (oph)
Les titrages sont suivis par potentiomètrie à l'aide d'une électrode de mesure en platine et d'une électrode de référence : l'électrode au calomel saturée (ECS).
Il est fournit avec l'énoncé les courbes en image
Les question sur lesquelles je bloques au début sont:
d) Certains points particuliers de la courbe permettent d'obtenir une valeur expérimentale des potentiels standard des couples oxydant/réducteur impliqués dans la réaction. Lesquels ?
e) Proposer une interprétation simple des écarts entre les valeurs obtenues expérimentalement et les données fournies.
Je n'ai pas vu dans mon cours, des courbes sur les potentiels avec des explications, je supposes qu'il faut répondre "à la demi-équivalence", mais je ne saurais expliquer pourquoi..
Ensuite il y aune deuxième partie:
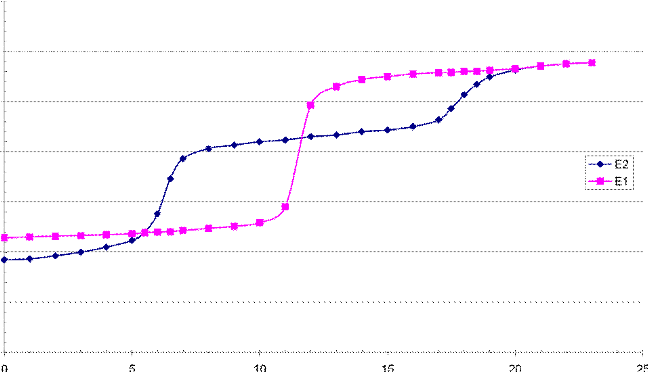
Le becher du dosage contient V0 = 20,0 mL de la solution A, 20 mL d'eau et 0,20 g d'orthophénanthroline. La burette contient la solution B. On obtient la courbe notée E2.
On suppose que l'orthophénanthroline, ajoutée en excès, forme des complexes stables avec les ions du fer et du cobalt contrairement aux ions du cérium qui ne donnent pas de complexes.
L'orthophénanthroline est un ligand bidentate qui forme des complexes de stchiométrie M(oph)3n+ où Mn+est un cation métallique.
la question:
b) Combien d'équivalence observe-t-on ? Ecrire les équations des réactions. En utilisant les résultats du premier dosage, déterminer l'ordre dans lequel elles se produisent.
enfaite la je ne sais pas ce qui va réagir, je supposes que c'est (oph) avec Fe2+ et Co2+ mais que viens faire Ce4+ alors?? et comment peut on déduire la concentration de l'autre ion dans le 1e dosage?? je ne vois pas
Merci d'avance pour votre aide
Bonjour
Juste quelques infos pour te permettre de comprendre ce qui se passe. Dans les deux cas, le réactif titrant est l'oxydant cerium IV.
Dans le premier cas Il est susceptible de réagir sur les ions fer (II) et cobalt (II). Les deux réactions sont-elles quasi totales ? Si non, un seul type d'ions va être titré. Un premier tableau d'avancement valide avant l'équivalence puis un second valide après l'équivalence montrent l'intérêt de la demie équivalence mais aussi celui d'un volume double du volume équivalent.
Dans le second cas, il faut envisager la réaction des ions cerium (IV) sur les ions fer (II) et sur les ions cobalt(II) complexés. Les deux réactions sont-elles quasi totales? Si oui les deux ions complexés sont dosés. Le rapport des 2 constantes d'équilibre est-il au moins égal à 10000? Si oui, les deux titrages sont successifs et indépendants.
Cela devrait t'aider à commencer...
Bonsoir
Un peu plus d'aide maintenant que j'ai récupéré mon pseudo antérieur.
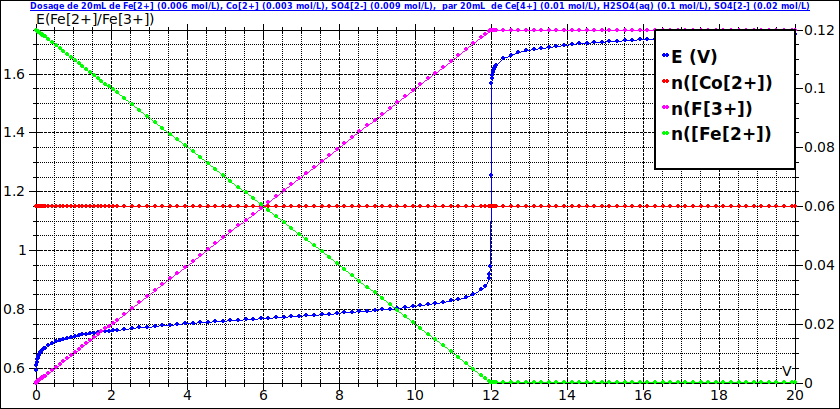
La première image correspond à une simulation de la première situation en posant Ve=12mL. À la courbe E=f(V) (en bleu, échelle de l'axe vertical gauche) j'ai ajouté les courbes correspondant aux variations en fonction de V des quantités des différents ions (échelle de droite). Cela illustre mon message précédent.
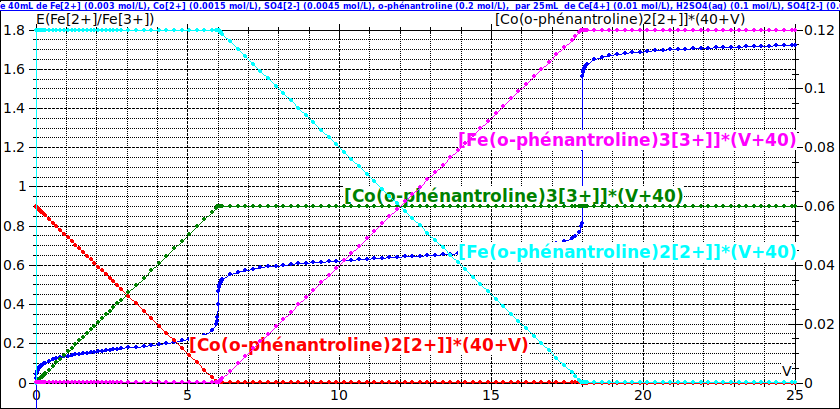
La seconde image correspond à la seconde situation en prenant : Ve1=6mL et Ve2=18mL. Le scan des courbes que tu fournis n'est pas très net. Cela m'a amené sans doute à arrondir un peu les valeurs des volumes équivalents mais il est important de comprendre pourquoi nécessairement : Ve=Ve2 - Ve1 ...
Là encore, à la courbe représentant les variations de E en fonction de V, je superpose les courbes correspondant aux variations des quantités des différents ions complexés. Le logiciel que j'utilise obtient les quantités en multipliant les concentrations par le volume total de la solution... Les potentiels sont ceux par rapport à l'électrode standard à hydrogène, la température étant de 25°C.