Inscription / Connexion Nouveau Sujet
Géométrie des molécules
Bonjour,
Pour m'entraîner ... Voici un petit exercice qui appuie sur des petits trucs que je n'ai pas encore bien pigé !
Je dois donner pour chaque molécule :
>> La forme AXmEn
>> Le degré d'hybridation
>> La forme de la molécule
>> L'angle caractéristique de cette forme
Je me suis fait un tableau et je sais comment trouver chaque valeur.
Pour H20 par exemple, j'ai trouvé :
>> OX2E2
>> sp3
>> Forme tétraédrique
>> 104,5° (ou 109,5°) ça dépend ce qu'on trouve sur le net / selon le prof
Cela me parait correct !
J'ai fait de même pour BCl3 :
>> BX3E0
>> sp²
>>forme triangulaire
>>120°
Là aussi je crois avoir bien pigé (je suis passé par B* -B hybridé-)
Je coince maintenant pour BrF4- :
A mon avis il faut aussi "hybrider" Br
Car la couche externe de Br est : 4s²4p5 soit 3 doublets et 1 seule liaison possible (or il nous faut 4 liaison possibles pour aller avec F)
Or si on ouvre une couche d, je ne vois pas comment faire apparaitre 4 liaisons possibles (2+5=7...en sachant qu'il me reste 7-4=3 liaisons à mettre en doublets) ???
MERCI D'AVANCE POUR VOTRE AIDE ! 
Il me semble qu'il serait plus simple de procéder ainsi :
- établir le schéma de Lewis d'un édifice et
---- bien verifier que les électrons externes des atomes le consitituant se retrouvent bien tous
---- les atomes C,N,O et F obéissent en général à la règle de l'octet
---- beaucoup d'autres atomes n'obéissent pas à la règle de l'octet
- la théorie VSEPR te permet de prévoir la géométrie de la molécule
- il y a un rapport entre cette géométrie et l'hybridation de l'atome central
pour les hybridations les plus simples : angles voisins de 109° : sp3 , angles voisins de 120° : sp2 , angle de 180° : sp et il existe d'autres hybridationsplus complexes comme d2sp3 .... etc ...
Salut  !
!
Courage ce sont des chapitres barbares mais des bases à assimiler 
Tu n'es pas obligé de remplacer la lettre A 
H2O : ok, moi je mets toujours  <109°28' et
<109°28' et  =104,5°
=104,5°
BCl3 : ok mais on dit trigonale 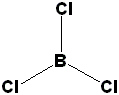
BrF4- : pour moi AX4E2 cad octaédrique avec plan carré
Désolée, je n'avais pas captée ta réponse anniejeanne (m'apprendra à laisser cramer la viande...  ). Et bonjour bien sûr
). Et bonjour bien sûr 
Shadowmiko : Il me semblait que dans la formule, le A représentait l'atome central donc qu'il fallait le remplacer...
Anniejeanne : Normalement je dessine ma molécule après avoir trouvé ma configuration électronique (et donc ma couche externe. Comment faire le shéma de Lewis avant cela ?? (j'avoue que je n'ai jamais été fan de cela...)
Ici, la configuration électronique de Br (Z=35) serait : 1s²2s²2p63s²3p63d104s²4p5Donc ma couche externe est 4s²4p5
Je dessine ma case 4s : j'ai un doublet !
Je dessine ma case 4p : j'ai 2 doublets et 1 simple...il y a donc une seule liaison possible avec le fluor
(or il m'en faut 4...voir 5 (puisque c'est F4-? non??)
Si j'hybride B pour trouver 4 liaisons simples :
case 4s : 1 doublet
case 4p : 1 doublet + 2 liaisons simples
case 4d : 2 liaisons simples
J'ai donc 2 doublets et 4 liaisons simples !
Le truc, c'est que 2+4+2 = 8 OR 2+5=7, je n'ai que 7 e- à placer (d'après ma couche externe de Br !!)
Après si je ne me préoccupe pas de cela, je trouve donc bien comme Shadowmiko :
>> BrX4E2
Et pour la suite :
>> d²sp3
>> forme octaédrique
>> 360/6 = 60°
Merci du temps que vous me consacrez !
Certes mais tu peux laisser le A pour décrire la forme
En attendant les éclaircissements d'anniejeanne je te donne quelques pistes :
1) tu comptes les doublets dispo Nv,mol =  Nv
Nv  charge
charge
 Nv concerne les éléments constitutifs de la molécule
Nv concerne les éléments constitutifs de la molécule
+ si charge <0
- si charge >0
Nombre de doublets : D = Nv,mol/2
2) Utiliser les doublets pour former des liaisons et compléter l'octet à l'aide de doublets non-liants
3) Attribuer les charges formelles
Comment faisais-tu en seconde avant de savoir toutes ces règles d'atomistique?
tu comptes les doublets dispo Nv,mol =
 Nv
Nv  charge
charge Nombre de doublets : D = Nv,mol/2
Et c'est donc pour cela que j'ai 2 doublets autour de Br !!!!!!!! OKKK ! (c'est ça?)
Utiliser les doublets pour former des liaisons et compléter l'octet à l'aide de doublets non-liants
Mais alors, le nombre d'électrons dans la couche externe de ma molécule n'a rien à voir avec le nombre de doublets ?????
Les électrons de valence te servent pour l'attribution des charges formelles (ça tu as compris le principe sur l'autre topic). D'une manière générale, la règle du duet et de l'octet s'applique très bien pour les éléments de la deuxième ligne, s'associant de façon à être entourés par 8 électrons dans la molécule formée
je vais reprendre comme te l'explique shadowmiko l 'édifice BrF4 -
- nombre d'électrons total : 7 pour Br + 4*7 pour les 4F +1 pour la charge soit total 36 e = 18 doublets au total
- on sait que Br n'obéit pas forcement à la règle de l'octet et le fluor obeit : on met donc Br , 4 doublets avec les 4 fluor , 3 doublets non liants autour de chaque fluor et ainsi on a placé 16 doublets. Il en reste 2 que l'on ne peut mettre que comme doublets non liants autour de Br .
- on a donc autour de Br un édifice AX4E2 octaédrique donc des angles de 90 ° ( la partie AX4 est peut-être plan carré? )
- l'hybridation de Br est d2sp3
les charges formelles sont :
pour Br : on lui attibue 2 doublets + 4*1 e de chaque liaison soit 8e , normalement il en a 7 donc il a une charge -
pour F: on lui attribue 3 doublets + 1 electron de liaison soit 7 e donc charge formelle 0


