Inscription / Connexion Nouveau Sujet
Formule acide base
Bonjour,
Dans un de mes coups, on me présente une méthode pour calculer le pH d'une solution d'acide fort on prend pour exemple la reaction qu'il y a entre HCl et H2O
La méthode se présente en trois étapes :
1)Poser les réactions chimiques
2) répertorier, les espèces en solution
3) relation entre les espèces
Dans l'etape 3) il est dit :
[H3O+]=[OH-] + [Cl-]
Je ne comprend pas pourquoi
Ensuite en solution il est proposé de resoudre une equation de second degré pour connaitre la concentration en H3O+
(Img)
et je ne comprend pas, je pensais que si l'acide était fort, la concentration en H3O+ était la même que la concentration en acide fort au depart (d'autant que je n'aurai pas de calculatrice durant le concours, et donc calculer une équation du second degré et plus long)
Merci
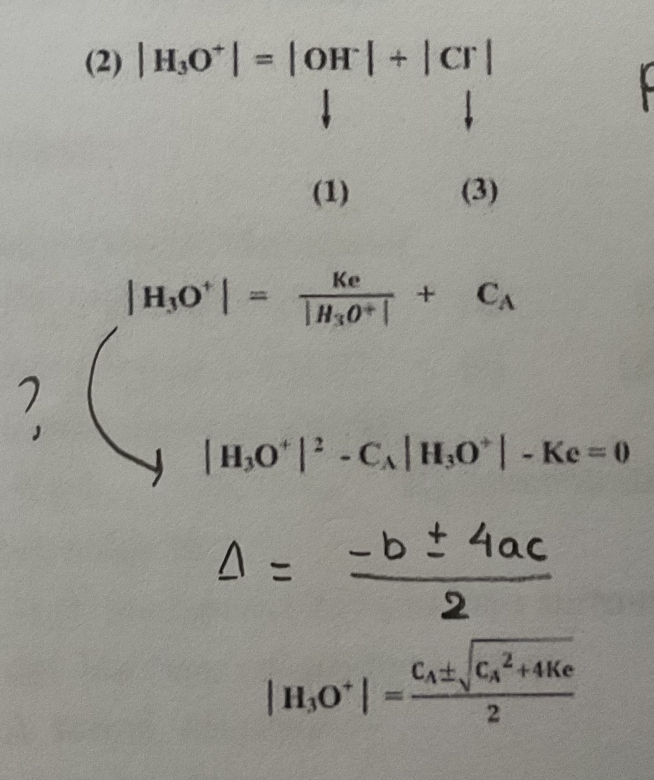
Bonsoir
On te présente la méthode la plus générale valide quelle que soit la valeur de Ca. La relation que tu ne comprends pas traduit simplement l'électro neutralité de la solution : chaque litre de solution contient autant de charges électriques positives que de charges électriques négatives.
En pratique, la concentration en ions hydroxyde peut être négligée tant que Ca>10-6mol/l. On obtient alors simplement [H3O +]=Ca comme tu le pensais.
D'accord donc c'est plus sure d'appliquer cette formule ?
Et aussi pouvez vous me dire comment on passe a l'equation de second degre (la ou j'ai mis la fleche et le point d'interrogation.
Merci
D'accord donc c'est plus sure d'appliquer cette formule ?
Relis bien mon précédent message. Appliquer cette formule n'est nécessaire que si Ca est tellement faible qu'il est impossible de négliger la présence des ions hydroxyde produit par autoprotolyse de l'eau.Reprends la relation d'électro neutralité. Dans une solution acide, nécessairement : [HO-]<10-7mol/L
Les ions chlorure sont des ions spectateurs : leur concentration est égale à la quantité introduite par litre : [Cl-]=Ca.
Donc, si Ca est nettement plus grand que 10-7mol/L, on peut négliger [HO-] dans la relation d'électroneutralité et poser simplement :
[H3O+]=Ca.
Autrement dit, résoudre l'équation du second degré n'est vraiment utile que si Ca n'est pas grand devant 10-7mol/L ; cette méthode est utilisée en pratique seulement pour Ca<10-6mol/L.
Et aussi pouvez vous me dire comment on passe a l'equation de second degre (la ou j'ai mis la fleche et le point d'interrogation.
Il suffit de multiplier tous les termes (à gauche et à droite du signe "=") par [H3O+].


