Inscription / Connexion Nouveau Sujet
Formes mesomeres
Bonjour,
Je suis face à un exercice dans lequel je dois donner les formes mesomeres les plus representatives de quelques ions ainsi que leur géométrie et angle valenciels. Le premier est le NO3-
J'ai réaliser la forme mesomere la plus representative, jen suis donc à donner sa géométrie. Sauf que je me rend compte que je ne sais pas pourquoi j'ai donné une charge positive au N si ce n'est pour obtenir la charge totale négative. Je me dis que comme l azote possède 5 électrons de Valence alors il devrait lui rester un électron célibataire, ce qui changerai la géométrie de la molécule... Pouvez vous m éclairez s'il-vous-plaît 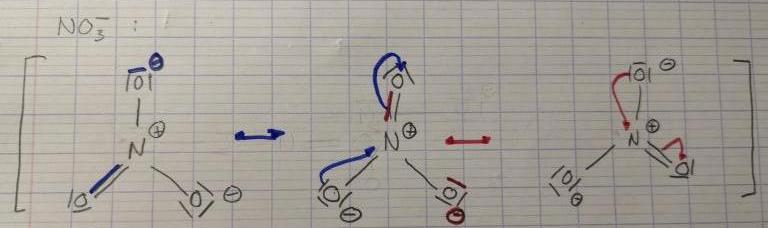
***Orientation changée***
Bonjour
Tes représentations tiennent bien compte du nombre total d'électrons de valence(5+3x6+1=24) et la règle de l'octet est respectée pour les quatre éléments. Ta représentation est a priori correcte !
Considère maintenant les charges locales :
Pour N : 4e- de liaisons en moyenne (4 liaisons covalentes) pour un noyau de charge +5e.
Pour O : un noyau de charge +6e avec
* dans un cas : 2 e- de liaison en moyenne (2 liaisons covalentes) et 4e- non liants
* dans les deux autres cas : 1 électron de liaison en moyenne (1 liaison covalente) et 6e- non liants...
Tu as raison pour les charges locales...


