Inscription / Connexion Nouveau Sujet
extension de l'octet
bonjour, j'ai un problème de compréhension de la notion de l'extension de la règle de l'octet ..
notamment avec l'ion de SO42-
Re-bonjour,
Pourrais-tu nous préciser ton niveau réel ?
Un coup tu postes en sixième, seconde, première, dans le supérieur, ça entretient le flou :
 extrait de
extrait de Q12 - Dois-je forcément indiquer mon niveau lorsque je poste un nouveau topic ?
Merci donc de mettre à jour ton profil et de poster systématiquement avec celui-ci.
Concernant ta demande :
Bonjour à tous
J'imagine que Yassmiss veut parler d'hypervalence à propos de l'atome S. Comme bien précisé par gbm, difficile de répondre sans connaître le niveau réel : orbitales atomiques, hybridation....
Ah, nonnn, vous voulez dire que le niveau que je dois mettre en dessous de chaque question que je pose ne correspond pas au niveau de la question en elle-même.. ??🤔🤔
Je l'ignorais, désolé.. Je croyais que ce niveau c'est pour la question et pas non niveau à moi… c'est pour ça que j'avais du mal à préciser à quel niveau cela correspond.. 😅😅
Concernant mon niveau! ?🤔🤔
Je pense que je l'ai indiqué lorsque je me suis inscrit dans le forum.. Je pensais que vous étiez capable de le voir!🤔🤔
Bon, ça fait rien je vous le dit quand même… eh, bien je suis en première année à l'université.. Bachelier biomédicale.. Voilà.. 😎😎
Je pose des questions parfois anciennes car j'aime apprendre la chimie depuis le début.. Et mon plus grave problème ce que je m'en foutais à l'époque.. Ce qui explique mon niveau très claqué actuellement…😓😓
Concernant, ma question.. J'ai beau pu réfléchir à comment je l'expose… mais j'ai n'ai pas trouvé d'autre moyen que de la prendre en photo.. Car je ne sais pas comment je peux l'écrire avec des flèches et tout.. Alors ne m'en voulez pas svp.. 😅😅
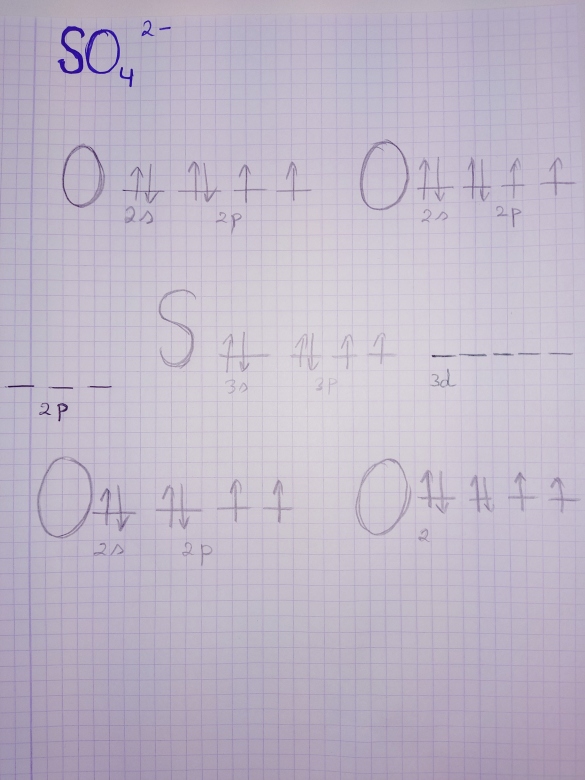
** image supprimée **
Voilà qui est plus clair ! En plus : tu réponds indirectement mais de façon précise à mon message de 15h46...
Pour l'hypervalence, tu y es presque avec tes schémas. Comme tu l'as indiqué sur tes schémas, l'atome S, contrairement à l'atome O, possède un niveau d vide. On peut donc envisager pour cet atome un état transitoire excité :
3s1 3p3 3d2
correspondant à 6 électrons célibataires occupant chacun une orbitale atomique. Cela donne donc à S la possibilité d'établir 6 liaisons covalentes au lieu de 2 comme dans H2S.
En fait, il y a stabilisation de la structure par effet mésomère. Les quatre liaisons sont équivalentes : la structure est de type tétraédrique et chaque atome O possède en moyenne une charge -½e.
J'ai pas fait exprès.. je l'ai exportée deux fois 😓😓
En fait, ce que je veux c'est pouvoir trouver la forme géométrique de l'ion SO42- en ayant une explication schématique pour mon examen.. C'est demandé ainssi.. 😥😥
SO3 je sais le faire.. Mais pour SO42- pas trop car cela ne réspecte pas là règle .. 🙄🙄
Je sais qu'il ya trois structures de lowis qui peuvent être réalisées… l'extension dit qu'il faut faire appelle à une sous-couche dont je l'ai déssiné en vert pour 3d et en noir pour 2p.. Je suis plus pour 3d 🤔🤔
Ce qui me gêne c'est les flèches qu'il faut déssiner mtn comme liaisons.. Car comme vous le dites le S même en ayant enfrin enfeint la règle il ne peut faire que 6 liaisons avec 3d..🤔🤔
en plus, ce que je comprends pas c'est qu'il est en forme ionique donc 2- que je ne sais même comment je dois représenté les 2- dans mon schémas.. Genre, est ce que ça vaut dire qu'il faut ajouter deux flèches de plus à S dans 3d pour pouvoir faire le reste des liaisons… !?🤔🤔
Ou c'est autre chose.. 😰😨🤯
non, ne me dites pas que je suis con !!! 
alors les deux cherges 2- de l'ion viennent des deux oxygènes qui n'ont pas pu se lier qu'une seule fois au S !!!
c'est donc ça !!!
je pesais que 2- c'était pour le S.. et moi qui essayer de trouver une place pour eux!!!
merci, le reste je sais le faire.. 
Ayant été absent le reste de l'après-midi, je vois que vanoise a pris le relai pour les explications, je vais donc uniquement répondre à ceci :
Ah, nonnn, vous voulez dire que le niveau que je dois mettre en dessous de chaque question que je pose ne correspond pas au niveau de la question en elle-même.. ????
Je l'ignorais, désolé.. Je croyais que ce niveau c'est pour la question et pas non niveau à moi? c'est pour ça que j'avais du mal à préciser à quel niveau cela correspond.. ??
Le niveau affiché sur ton profil est "terminale S" mais c'était en 2019, est-ce toujours le cas ? Sinon, il faut que tu le mettes à jour maintenant et à chaque rentrée.
Une fois que ce sera fait (si pas terminale S), il faut dans ce cas poster chaque sujet dans le même niveau que celui posté dans ton profil pour ne pas perturber les aidants (qui cherchent à t'apporter une réponse adaptée à ce niveau et non pas te proposer des éléments hors programme par exemple).

Oups, il me manque un bout :
Concernant mon niveau! ?🤔🤔
Je pense que je l'ai indiqué lorsque je me suis inscrit dans le forum.. Je pensais que vous étiez capable de le voir!🤔🤔
Bon, ça fait rien je vous le dit quand même… eh, bien je suis en première année à l'université.. Bachelier biomédicale.. Voilà.. 😎😎
Dans ce cas, mets à jour ton profil en "licence" et poste sur ce niveau désormais, quitte à préciser dans ton sujet que tu cherches à réviser des notions abordées au lycée.

Ok, gbm. .. Je vois… mais ce n'est pas de ma faute si j'ai une question qui ne correspond plus à mon niveau.. Car l'homme ne connait pas tout dans la vie… et oublie plein de trucs.. 😎😎
Je metterai mon profil à jour.. Par contre, si j'ai une question peu importe au quel niveau, puis-je là poser ici. ??🤔🤔
Merci d'avance,
Ok, gbm. .. Je vois? mais ce n'est pas de ma faute si j'ai une question qui ne correspond plus à mon niveau.. Car l'homme ne connait pas tout dans la vie? et oublie plein de trucs.. 😎😎
Je metterai mon profil à jour.. Par contre, si j'ai une question peu importe au quel niveau, puis-je là poser ici. ??🤔🤔
Merci d'avance,
Je te conseille de mettre à jour aujourd'hui car après tu seras sous le joug d'un avertissement. Il suffit de cliquer sur ton pseudo dans la colonne de gauche et d'aller renseigner le niveau d'étude dans "Mon profil".
Concernant ta deuxième question : de manière générale, 1 sujet créé = 1 exercice = 1 question de cours.
Si ta question est liée à l'hypervalence, tu peux poursuivre ici. S'il s'agit d'une question en lien avec un autre chapitre, il faut créer un nouveau sujet.
L'intérêt est de maintenir des archives propres pour des recherches futures dans les moteurs.

Un rappel (peut-être inutile ?) sur la manière de déterminer les charges électriques formelles sur chaque atome d'une structure de Lewis.
Pour un atome donné :
- chaque doublet non liant compte pour deux électrons (électrons non partagés) ;
- chaque doublet liant compte pour un électron (ce doublet est partagé entre deux atomes pour établir une liaison covalente);
Il suffit de comparer cette somme au nombre d'électrons de valence.
Cela conduit bien au résultat que tu as décrit précédemment. 

 équivalences des systèmes de niveaux scolaires
équivalences des systèmes de niveaux scolaires
