Inscription / Connexion Nouveau Sujet
exploitation d'une courbe de titrage
Bonsoir,
Voici un exercice qui me pose problème :
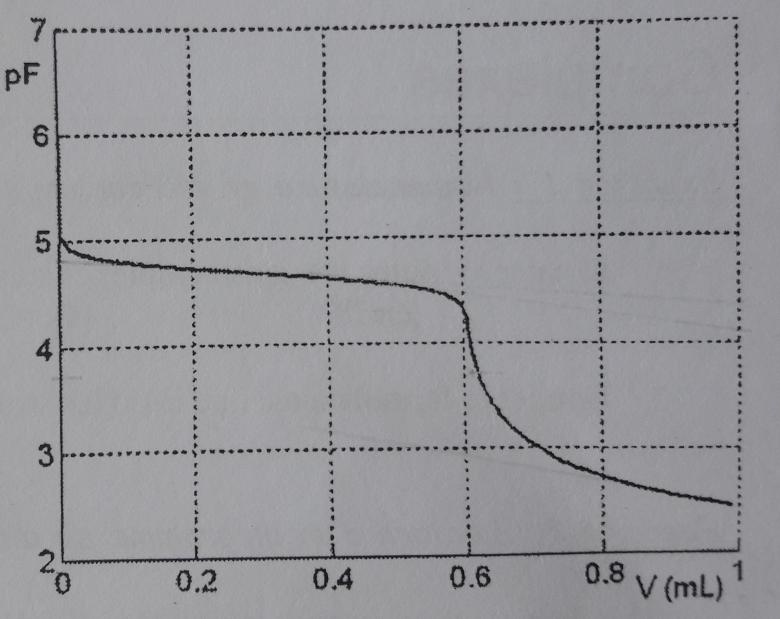
On dose un volume Vo=10 mL d'une solution d'ions Al3+ de concentration Co=1,0.10-3mol.L-1 par une solution d'ions fluorure à la concentration C1=0,10 mol.L-1. On suit l'évolution de pF=-log[F-] en fonction de V, volume de la solution d'ion fluorure versé.
Déterminer la formule du complexe formé.
Dans la réaction il y a écrit que la réaction de titrage est Al3++nF-=AlFn .
.
Je ne comprends pas pourquoi la réaction n'est pas Al3++F-=(AlF)2+. Comment sait-on qu'on doit chercher le nombre de ligands ? D'habitude dans les exercices on ne doit pas chercher le nombre de ligands donc je ne comprends pas pourquoi il faut le faire ici....
Merci d'avance pour vos explications
Bonsoir
Il y a lieu de tenir compte des réactions de complexations successives s'il est possible de définir un domaine de prédominance pour chaque complexe intermédiaire. Si ce n'est pas le cas, on peut envisager que l'ion aluminium fixe n ligands à la fois. J'imagine que ton diagramme ne permet de mettre en évidence que deux domaines de prédominance : celui de l'ion aluminium et celui du complexe global AlFn3-n
Je suis désolée je n'ai pas compris ton explication. Quand tu parles de diagramme de prédominane cela signifie qu'il faut en faire un ? On n'a pas de diagramme de prédominance donné dans l'énoncé on a juste un suivi pH-métrique. Est-ce que tu pourrais réessayer de m'expliquer s'il-te-plaît parce-que ça me semble très flou.....
Attention : il y a des analogie entre échanges de ligands et échanges d'ions H+ mais il ne s'agit pas ici de pH-métrie. Peux-tu scanner ici la courbe à interpréter ? Cela permettra ensuite d'être plus précis.
La quantité introduite d'ions aluminium est no=Co.Vo=10-5mol
Puisque pF=-log([F-]), on peut dire que, malgré l'ajout d'ions fluorure, la concentration de cet ion reste extrêmement faible pour V<0,6mL pour se mettre à augmenter brutalement pour V>0,6mL. Cette absence de diminution s'explique par la formation d'ions complexes. On peut en conclure que les réactions de complexations consomme une quantité d'ion fluorure égale à n1=C.V=6.10-5mol soit n1=6no
L'ion aluminium peut donc se lier au maximum à six ions fluorure (ligands).
Pourquoi le fait que n1=6no signifie que l'aluminum peut se lier au maximum ) 6 ions fluorure ? (je vois bien qu'il y a un 6 mais je ne comprends pas comment on en déduit que ça signifie cela)
Evidemment, il faudrait s'assurer qu'il n'existe pas un second saut de pF pour un volume V supérieur à 1mL mais il faut faire confiance à l'énoncé pour fournir toute la partie utile de la courbe.
Quelques renseignements complémentaires, peut-être inutiles... J'ignore les exigences exactes de ton programme. Je note M l'ion métallique et L un ligand. Si n ligands sont susceptibles de se lier à M, on obtient les équilibres :
M+L=ML constante de formation :  1
1
ML+L=ML2 constante de formation :  2
2
....
MLn-1+L=MLn constante de formation :  n
n
Si, comme ici, on ajoute progressivement une solution contenant L à une solution de M, plusieurs cas sont envisageables.
1er cas : (celui de ton exercice) : les n constantes de formations sont toutes très grandes devant 1 et du même ordre de grandeur. On observe un seul saut pour la courbe pL=f(V), lorsque les n réactions de complexation sont terminées. On peut traiter le problème comme s'il existait uniquement la réaction globale :
M+nL=MLn constante globale de formation :  =
= 1.
1. 2. ...
2. ...  n
n
2ième cas : les différentes constantes de formations sont toutes très grandes devant 1 tout en étant très différentes les unes des autres : 1020 ; 1016 ; 1011 ... par exemple. Les n réactions de complexation peuvent être considérées comme successives, indépendantes et quasi totales. On va obtenir n sauts successifs pour la courbe pL=f(V).
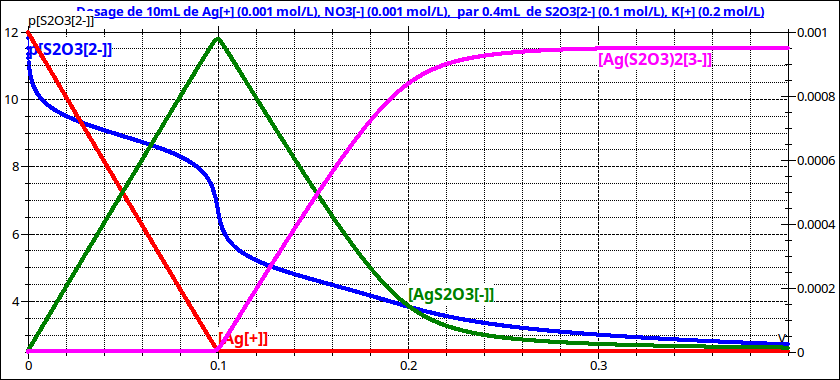
Malheureusement, de très nombreux autres cas peuvent être envisagés, d'où la nécessité d'une étude au cas par cas. Par exemple : pour M=Ag+ et L=S2O32-, il existe deux complexes successifs correspondant à :
 1=108,8 ;
1=108,8 ;  2=104,7.
2=104,7.
On constate :  1>>1 et
1>>1 et  1>104.
1>104. 2
2
La première réaction peut être considérée comme quasi totale et les deux réactions sont successives et indépendantes. Cela conduit à un premier saut de pL (V=0,1mL) pour lequel, [M] 0 et [ML2]
0 et [ML2] 0 : la première réaction est terminée et la seconde pas encore commencée. La situation se complique ensuite :
0 : la première réaction est terminée et la seconde pas encore commencée. La situation se complique ensuite :  2 n'est pas suffisamment grand devant 1 pour que la seconde réaction de complexation puisse être considérée comme quasi totale. On n'obtient donc pas de second saut de pL en V=0,2mL. D'ailleurs, on constate que, pour ce volume, [ML1] n'est pas négligeable, la réaction n°2 de complexation n'est pas terminée.
2 n'est pas suffisamment grand devant 1 pour que la seconde réaction de complexation puisse être considérée comme quasi totale. On n'obtient donc pas de second saut de pL en V=0,2mL. D'ailleurs, on constate que, pour ce volume, [ML1] n'est pas négligeable, la réaction n°2 de complexation n'est pas terminée.
Le suivi de la courbe pL=f(V) n'est donc pas nécessairement une bonne méthode pour obtenir n, le nombre maximum de ligands. La méthode n'est applicable que si les n constantes de formation successives sont toutes très grandes devant 1.
Ok merci c'est très complet, c'est plus clair maintenant 
J'ai juste une question concernant les cas 1 et 2 : si on ne nous donne pas de graphique mais uniquement des constantes, à partir de quels "écarts" de valeurs entre les constantes peut-on considérer qu'on va avoir un saut de pH ou plusieurs sauts de pH ?
En pH-métrie, les dosages des deux acidités d'un diacide peuvent être considérés comme successifs et indépendants si l'écart entre les pKa est d'au moins 4. Par analogie, cela revient à considérer que le rapport entre deux constantes de formation successives est d'au moins 104 . Attention : il faut aussi que chaque constante soit très grande devant 1 : voir exemple fourni précédemment.
Autre exemple avec n=4 :
 1=1020
1=1020
 2=1019
2=1019
 3=1010
3=1010
 4=103
4=103
Combien de sauts à la courbe pL=f(V) à ton avis ?