Inscription / Connexion Nouveau Sujet
Étude conductemetrique d’un dosage
Bonsoir à tous!
j'ai un exercice de chimie assez ardu vu qu'il est un peu inhabituel vu qu'il y a plusieurs réactifs à titrer.
voici l'enoncé:
On prélève un volume V1= 10,0mL d'une solution de soude (Na+, OH-) à doser.
On ajoute ensuite une solution de sulfate de nickel (Ni2+,SO42-) de Volume V2= 20,0 mLà doser également. Après avoir ajouté 50mL d'eau déminéralisée, on ajoute le tout et on obtient un mélange A de volume totale V0.
On trempe ensuite une cellule conductimetrique dans A, et on ajoute progressivement une solution titrante d'acide ethanoique de volume V=20 mL et de concentration c=0,5mol.L-1connue, en relevant du nouveau mélange la conductance G jusqu'à versement total de l'acide.
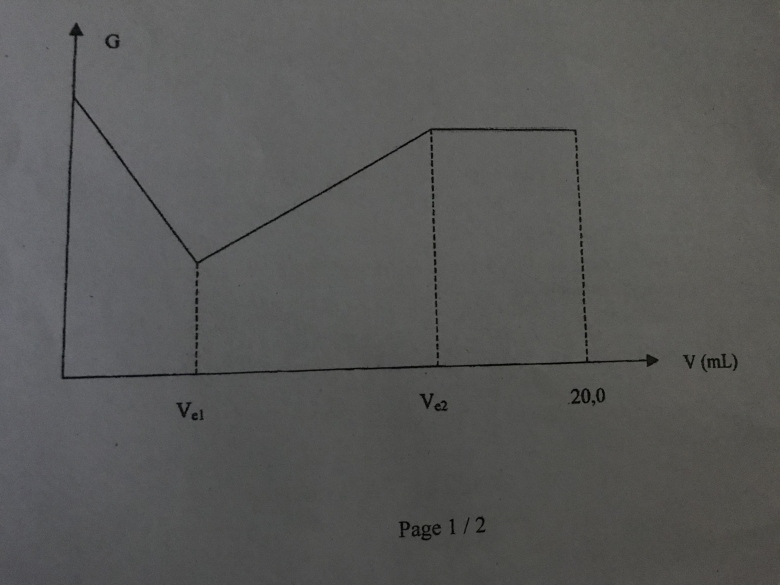
On obtient une courbe que vous pouvez voir tout en bas.
Comme vous le voyez, il y a deux volumes équivalents, un egal à Ve1=6,0mL et l'autre V2=14,0mL. On observe également que le mélange A renferme un précipité vert d'hydroxyde de Nickel Ni(OH)2 très peu soluble au début du dosage, et qui se dissout progressivement lors de l'ajout de l'acide. Pour Ve2, le melange est limpide.
On me demande d'ecrire la réaction de titrage pour Ve1<V<Ve2
Et je n'y arrive pas car je ne sais pas ce que donne la réaction de l'hydroxyde de Nickel avec l'acide ethanoique (c'est un problème que je rencontre très souvent, quels peuvent être les produits??) et en plus, je ne sais pas si c'est le précipité vert qui réagit en se dissolvant.. en tout cas, j'ai d'abord dit que la réaction de l'acide avec la base la plus forte, càd la soude se produit d'anord Et j'ai écrit la réaction de titrage, mais je bloque complètement pour la deuxième.. Pouvez-vous m'aider svp?
Bonjour
Pour interpréter la courbe fournie, il faut supposer la soude introduite en excès par rapport aux ions nickel : la quantité introduite de soude est supérieure au double de la quantité introduite d'ions nickel puisqu'un ion nickel consomme deux ions hydroxyde par précipitation. Avant que ne commence l'ajout d'acide éthanoïque, la solution à doser est donc une solution de soude (celle ajoutée en excès) en présence d'un précipité vert d'hydroxyde de nickel.
1° : 0<V<Ve1
Dosage de la soude excédentaire :
On voit bien qu'ajouter une molécule d'acide éthanoïque se traduit par la disparition d'un ion hydroxyde et l'apparition d'un ion éthanoate. La conductivité molaire de l'ion hydroxyde étant très supérieure à celle de l'ion éthanoate, la réaction se traduit par une diminution de la conductivité de la solution.
2° : Ve1<V<Ve2
Disparition progressive du précipité :
L'ajout de deux molécules d'acide éthanoïque se traduit par la formation de deux ions éthanoate et d'un ions nickel. Cela se traduit par une augmentation importante de la conductivité de la solution.
3° : V>Ve2
Le titrage est terminé, l'ajout d'ajout d'acide éthanoïque se traduit par une réaction très limitée de l'acide sur l'eau :
L'ajout d'acide éthanoïque se traduit donc par une augmentation de la quantité d'ions en solution. La conductivité de la solution diminue. Cependant, contrairement aux deux premières réactions qui peuvent être considérées comme quasi totales, cette troisième est très limitée : la baisse de conductivité est donc relativement faible.
Remarque : la théorie sur la conductivité que tu connais n'est valide que pour des concentrations faibles, pas plus de 0,01mol/L. Je pense qu'il aurait été préférable de diluer au dixième, ou même au centième, la solution initiale avant de commencer le dosage...
La simulation réalisée ci-dessous pourra peut-être t'aider.
A la courbe (en bleu) représentant les variations de la conductivité gamma, sont superposées des courbes traduisant les variations de quantité de différents ions ou solide. On voit clairement que les deux réactions de dosages sont totales et successives.
Après la seconde équivalence, la réaction de l'acide éthanoïque qui est ajouté produit très peu d'ions éthanoate car la courbe verte reste quasi horizontale.
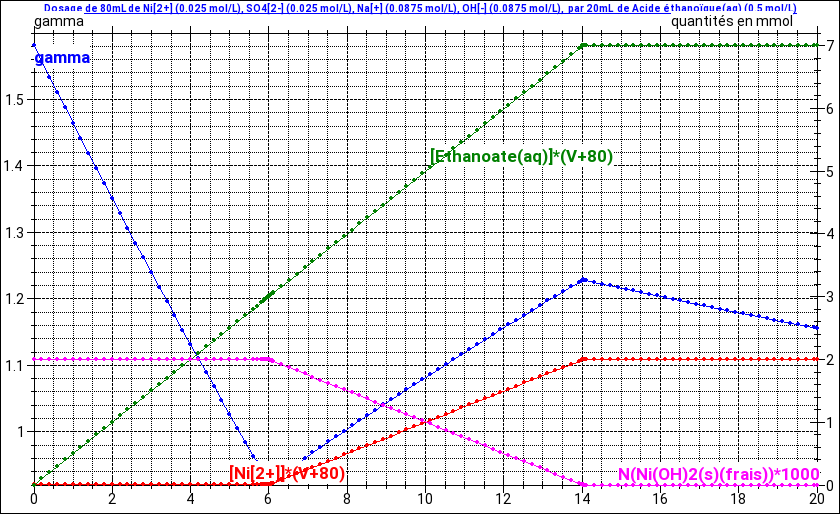
Petite mise au point concernant l'interprétation de la courbe gamma=f(V) que j'ai faite dans mon message du 31-01-19 à 10:20.
Elle concerne uniquement la troisième partie : V>Ve2 ;
Ce que j'ai écrit concernant la réaction très limitée de l'acide éthanoïque sur l'eau est exact mais cela n'explique pas la faible diminution de la conductivité : une très faible augmentation de la quantité d'ions devrait au contraire augmenter la conductivité ! J'ai oublié de parler du phénomène de dilution : ajouter la solution d'acide éthanoïque augmente très peu la quantité d'ions mais augmente le volume donc diminue les concentrations. Or la conductivité de la solution dépend des concentrations en ions...
Bonjour Vanoise!
Merci beaucoup de m'avoir répondu si précisément et je suis désolé du temps que j'ai mis à répondre, je n'avais pas accès à internet...
Il y a une chose que je n'ai pas comprise: vous écrivez que pour V1eq<V<V2eq, 2 moles d'acide éthanoique réagissent avec 1 mole d'hydroxyde de nickel mais je ne sais pas comment vous faites pour trouver ces coefficients en sachant qu'on est seulement sûrs de trouver des ions nickel et éthanoates comme produits n'est-ce pas? Et oui merci beaucoup, je ne comprenais pas vraiment pourquoi l'apparition d'ions ethanoates après la deuxième équivalence n'augmentait pas la conductance, et c'est sans doute pour ça que l'énoncé ne nous demandait pas ce qui de passait après Ve2.
J'ai une autre question dans le devoir que je n'arrive pas à faire. Après avoir calculé les concentrations de soude et de sulfate de nickel en solution, j'ai calculé la concentration molaire d'ion Nickel pour le volume V=12,0 mL et ensuite calculé le Ks du couple (CH3COOH,CH3COO-) grâce au pH qui vaut 7,90 pour ce volume. Mais on me demande de calculer le pKa du couple (CH3COOH,CH3COO-) pour V=20,0 mL en sachant que pH=5,10 pour ce volume.
on a pH=pKa + log([CH3COOH]\[CH3COO-]) et je connais la concentration d'acide éthanoïque qui vaut c=0,5 mol.L-1 mais la concentration en ions ethanoates est inconnu car elle vaut [CH3COO-]=2x, où x est l'avancement molaire de la réaction (2) que vous avez écrite. Le problème est que je ne connais pas x.
Comment peut-on faire?
Merci encore!
Il y a une chose que je n'ai pas comprise: vous écrivez que pour V1eq<V<V2eq, 2 moles d'acide éthanoique réagissent avec 1 mole d'hydroxyde de nickel mais je ne sais pas comment vous faites
Regarde bien les coefficients de l'équation de la réaction prépondérante et quasi totale se produisant entre Ve1 et Ve2 : tu constateras qu'il faut deux fois plus 'aid éthanoïque que d'hydroxyde de nickel pour passer de V=Ve1 à V=Ve2.
Ensuite, je relève quelques confusions :
1° Il s'agit surement de déterminer le produit de solubilité de Ni(OH)2. Pour V=12mL :6mL d'acide éthanoïque ont servi à la dissolution de l'hydroxyde de nickel alors qu'il faut 8mL pour provoquer la dissolution totale. Les 3/4 de l'hydroxyde de nickel est donc ainsi dissout, ce qui veux dire que la quantité d'ions Ni2+ vaut les 3/4 de la quantité initiale introduite. Tu peux donc calculer [Ni2+] sachant que le volume de la solution vaut 92mL. La valeur du pH conduit à [HO-] puis :
Ks=[Ni2+].[HO-]2
Il te faut enfin déterminer le pKa du couple acide éthanoïque/ion éthanoate à partir du pH à V=20mL. Attention : tu as commis une inversion dans ta formule...
Les 14 premiers mL d'acide versés se sont quasi intégralement transformés en ions éthanoate. Les 6mL suivant d'acide versés restent sans réagir de façon significative. Tu peux donc simplement poser :
Connaissant le pH, tu obtiens le pKa...


