Inscription / Connexion Nouveau Sujet
Etude cinétique
Bonjour !
Je bloque actuellement sur un problème de chimie et j'aurais besoin d'aide svp!
Voici l'énonce, les questions et mes réponses:
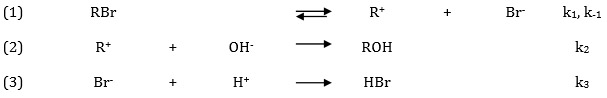
La réaction précédente peut être également décrite comme la succession d'étapes élementaires regroupées dans la séquence suivante et associées a des constantes de vitesse (cf image jointe)
1. Retrouver les nombres stchiométriques, , pour chaque étape élémentaire.
-> Nombres égaux à 1, les étapes élémentaires ne se produisent qu'une fois dans le mécanisme
2. Il est possible dappliquer l'AEQS sur les intermédiaires
et . Rappeler ce que signifie l'acronyme AEQS et ce que cela veut dire d'un point de vue expérimental sur ces intermédiaires.
-> L'acronyme AEQS signifie « Approximation de l'Etat Quasi Stationnaire ».
3. Utiliser cette approximation pour retrouver les égalités existantes entre les vitesses des étapes élémentaires de cette séquence.
-> Pour
Pour
4. Déterminer l'expression littérale de la concentration en [R^+] et l'expression détaillée de la vitesse de cette réaction.
-> Là par contre je suis bloqué....
Voilà, je vous remercie d'avance pour votre aide! 
Bonjour
Le mécanisme ne semble pas complet : d'où viennent les ions H+ et OH- ? Quelle est ton équation bilan ?
Bonjour
Le mécanisme ne semble pas complet : d'où viennent les ions H+ et OH- ? Quelle est ton équation bilan ?
Pardon effectivement je n'avais pas mit l'équation bilan:
Et la cinétique de formation de H+ et OH- à partir de l'eau n'est pas modélisé ?
A priori un mécanisme réactionnel doit avoir pour bilan l'équation bilan...
la cinétique de formation de H+ et OH- à partir de l'eau n'est pas modélisé ?
A priori un mécanisme réactionnel doit avoir pour bilan l'équation bilan...
la cinétique de formation de H+ et OH- à partir de l'eau n'est pas modélisé ?
A priori un mécanisme réactionnel doit avoir pour bilan l'équation bilan...
En fait l'eau est en excès (c'est ce qui était vu dans la 1ere partie du devoir)
Il te faut alors choisir une expression simple de la vitesse de réaction compte tenu de l'équation bilan. Sans doute le plus simple consiste à poser : v=v2 ou v = v3
Tu obtiens la concentration en R+ qui intervient dans v2 en appliquant l'AEQS aux deux espèces instables.
Si l'eau est en excès, peut-être peut-on poser : [H+]=[OH-]=10-7mol/L ?


