Inscription / Connexion Nouveau Sujet
étalonnage de la soude
Bonjour,
Voici un exercice qui me pose problème :
Principe de l'étalonnage de la soude par l'hydrogénoorthophtalate de potassium
L'étalon choisi est l'hydrogénoorthophtalate de potassium noté KAH.
1.1 Etablir l'équation de la réaction support de l'étalonnage.
Voici ce que j'ai fait
KAH -->
NaOH -->
Le problème c'est qu'ensuite je ne peux pas mettre en réactif et du coup je ne sais pas comment faire.
En fait, je ne sais pas comment on écrit la réaction support d'un titrage plus généralement  alors que c'est un peu du programme de terminal......et je ne comprends pas non plus pourquoi dans certains cas, quand on dissocie une espèce "forte" on met de l'eau et dans certains cas on n'en met pas. Par exemple on fait : NaOH -->
alors que c'est un peu du programme de terminal......et je ne comprends pas non plus pourquoi dans certains cas, quand on dissocie une espèce "forte" on met de l'eau et dans certains cas on n'en met pas. Par exemple on fait : NaOH --> et HCl + H20 --> H30+ + Cl-
Merci d'avance pour votre aide !
AH- est une espèce amphotère : c'est à la fois la base conjuguée de H2A et l'acide conjugué de A2-.
En présence de soude il se comporte en acide en fournissant un ion H+ à un ion hydroxyde de la soude. La réaction est quasi totale car sa constante d'équilibre est très grande devant 1. La réaction de titrage est donc ici :
AH- + HO- = H2O + A2-
Par ailleurs : un acide réagit sur l'eau en cédant à une molécule d'eau un ion H+, produisant ainsi un ion oxonium :
HCl + H2O = H3O+ + Cl-
Une base réagit sur l'eau en captant un ion H+ à l'eau, transformant celle-ci en ion hydroxyde :
NH3 + H2O = NH4+ + HO-
Reste le cas de certains hydroxydes métalliques ioniques comme l'hydroxyde de sodium ; en présence d'eau, les ions se dispersent parmi les molécules d'eaux et se solvatent sans qu'il y ait à proprement parler de réaction chimique. Si le solide se dissout totalement dans l'eau, on parle de base forte :
NaOH(s) = Na+ + HO-
Je suis bloquée à nouveau dans 2 questions qui suivent
On a : M(KAH)=204,1 g/mol ; Ka1= et Ka2=10^{-5,5}
On nous demande de calculer la masse de KAH à peser pour doser de la soude 0,1mol/L avec un volume équivalent proche de 15 mL. J'ai trouvé m= 0,153 g. Est-ce que c'est juste ?
Pour réaliser le dosage, la masse précédemment calculée de KAH est dissoute dans 50 mL d'eau. Le dosage est réalisé en présence d'un des trois indicateurs colorés suivants :
rouge de méthyle : zone de virage : 4,2-6,3 (rouge - jaune)
bleu de bromothymol : zone de virage : 6,0-7,6 (jaune - bleu)
phénolphtaléine : zone de virage : 8,3-10,0 (incolore - rouge)
En se basant sur un raisonnement qualitatif simple, indiquer quel indicateur coloré peut être utilisé.
Comme AH- est un acide, je pense qu'on n'utilisera pas la phénolphtaléine car son pH est supérieur à 7 et on devrait obtenir un pH qui y soit inférieur.
Après je ne sais pas du tout comment faire la différence entre les deux autres indicateur colorés.
Calculer le pH à l'équivalence de ce dosage et justifier à nouveau le choix de l'indicateur coloré.
Je ne sais pas trop comment faire pour déterminer ce pH. J'ai écrit qu'à l'équivalence on avait :
H20 + A2- = HO- + HA-
Mais comme on a alors ça veut dire qu'à l'équivalence on peut aussi avoir 2AH- = A2- + AH2 non ?
Du coup, je suis partie de l'équation : H20 + A2- = HO- + HA-
EI
J'ai calculé K°=10^(-8,5)
On a
Ensuite je ne sais
H20 + A2- = HO- + HA-
EI / 0 0
EF /
J'ai calculé K°=10^(-8,5)
On a
Ensuite je ne sais pas comment calculé le pH. Je n'ai pas trop compris certains aspects de ces calculs de pH : par exemple je ne comprends pas pourquoi on ne peut pas appliquer la méthode à chaque fois qu'on a HO- en produit. Ici j'aurais utilisé cette technique mais je ne sais pas si c'est une bonne idée.
Merci d'avance !
Pour les indicateurs : il faut que le pH à l'équivalence appartienne à la zone de virage de l'indicateur. De façon simplifiée, tu peux retenir :
dosage acide fort - base forte : pHéq = 7 ; le BBT est le plus approprié
dosage acide fort - base faible : pHéq<7 ; le rouge de méthyle est souvent le plus approprié
dosage acide faible - base forte : pHéq >7 ; la phénolphtaléine est souvent l'indicateur le plus approprié.
Ici, comme précédemment indiqué, il s'agit de faire réagir l'acide faible HA- sur la base forte HO- : il faut a priori utilisé la phénolphtaléine
il manque le à droite de ces lignes :
Je suis désolée, mon ordi beugue et je n'arrive pas à afficher ces deux lignes de calculs avec le
Je ne comprends pas pourquoi la phénolphtaléine est l'indicateur le plus adapté, cela signifie qu'on aura un pH>7 à l'équivalence ???? Je trouve ça bizarre étant donné que AH- est un acide 
Il s'agit de faire réagir une base forte (la soude) sur un acide faible AH- ; tu as raisonné comme s'il s'agissait de faire réagir la soude sur un diacide faible AH2.
Je t'ai fourni la réaction de titrage dans mon message du 25-11-17 à 14:09 (première équation écrite).
Compte tenu de celle-ci, le mélange est à l'équivalence une solution d'orthophtalate de potassium (2K+ + A-2)
A2- est une base faible : il est donc normal d'obtenir à l'équivalence un pH nettement supérieur à 7.
Dans ces conditions, il faut tout reprendre...
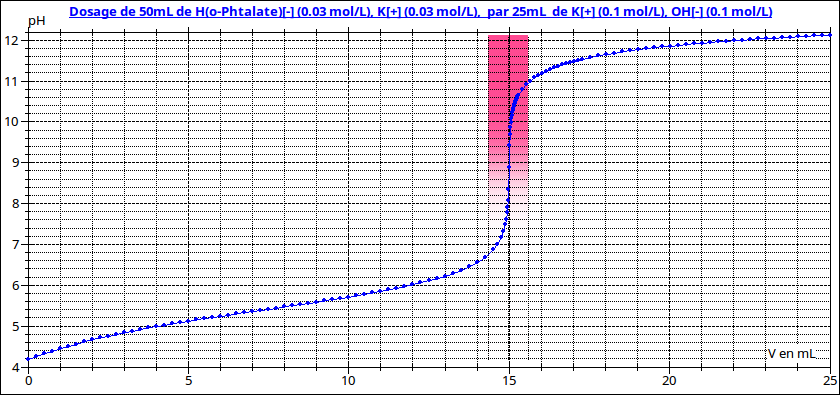
Si cela peut t'aider : voici la courbe traduisant la variation de pH en fonction du volume de soude ajoutée ainsi que l'échelle des teintes pour la phénolphtaléine. Le pH à l'équivalence vaut 8,9. Cet indicateur convient parfaitement.
Dans mon cours on écrivait une réaction différente pour chaque "étape". Par exemple avec CH3COOH/CH3COO- titré avec de la soude on avait à l'équivalence :
CH3COO- + H20 = HO- + CH3COOH et on calculait le pH à l'équivalence à partir de cette équation. En fait, notre prof de l'année dernière n'a jamais trop parlé d'équation de titrage : on faisait une équation pour V=0, une autre pour 0<V<Véq, une autre pour V=Véq, une autre pour V>Véq et du coup je ne sais pas du tout raisonner à partir de l'équation de titrage parce-qu'on ne s'en servait jamais.
Du coup, j'ai essayé de faire pareil que ce qu'on faisait avec ma prof et c'est pour cela que j'ai obtenu H20 + A2- = HO- + HA-
Ensuite, dans le chapitre précédent sur les calculs de pH, il y a écrit que pour un acide faible, pH=1/2(pKa-log(co))
Est-ce qu'ici on calcule le pH en tenant compte de l'acide faible utilisé (et on aurait donc pH=1/2(pKa-log(coVo)) j'imagine) ou en tenant compte de la base faible obtenu (et du coup on aurait pH=1/2(pKe+pKa+log(coVo))? Je pense plutôt que c'est le 1er cas mais j'ai peur de dire des bêtises. Du coup, à partir de quelle réaction le calcule-t'on ?
Je sais que je suis nulle en physique-chimie mais je fais de mon mieux pour essayer de comprendre et de progresser donc j'espère que ça va s'améliorer.
Pour la phénolphtaléine je pense avoir compris : il faut regarder en fonction de ce qui est obtenu à l'équivalence et donc ici on obtient une base faible d'où le pH supérieur à 7, il ne faut pas tenir compte des réactifs : est-ce que c'est ça ?
Tu sembles mélanger deux choses :
1° La réaction de dosage, c'est à dire la réaction quasi totale qui se produit avant l'équivalence. Il s'agit de celle fournie dans mon message du 25-11-17 à 14:09. C'est de cette réaction qu'il faut déduire la quantité initiale de KAH nécessaire pour obtenir un volume de soude ajouté à l'équivalence de 15mL.
2° Le cas particulier de l'équivalence où la solution, comme expliqué dans mon message précédent, est une solution de K2A de concentration :
En négligeant l'influence de la seconde basicité, la réaction prédominante à l'équivalence est :
A2- + H2O = AH-+HO-
Tu as sans doute démontré en cours :
Nos messages se sont croisés. Je réponds aux deux derniers.
OK pour la masse de KAH : il ne fallait pas diviser par 2 !
Je pense aussi que tu as compris pourquoi on choisit la phénolphtaléine ! 


