Inscription / Connexion Nouveau Sujet
dosages
Bonsoir,
j'ai des exercices en chimie des solutions a faire mais je bloque beaucoup... si quelqu'un peut m'aider!
voici l'énoncé du premier exercice:
Soient 100 mL d'une solution d'acide nitrique HNO3 10-1 mol L-1 que l'on dose par KOH 1 molL-1.
- Écrire la réaction de dosage
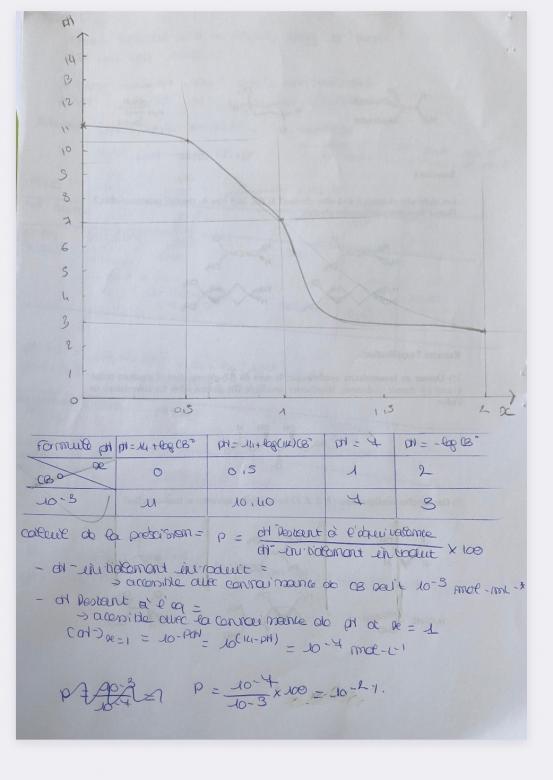
Aux différents points caractéristiques du dosage
- Faire le bilan des espèces majoritaires
- En déduire l'espèce / les espèces qui impose /imposent le pH
- Donner la formule de pH adaptée et faire l'application numérique
- Reporter les points dans un repère pH = f(x)
- Relier les points en respectant l'allure attendue pour le dosage d'un acide fort par une base forte
Calculer la précision du dosage et conclure.
Je sais ce qu'il faut faire mais je n'arrive pas a établir le tableau d'avancement avec les différentes équivalences (EI, (1/2)eq, eq et double eq). Dans mon cours on obtient a la fin deux courbes différentes avec le OH- initialement introduit et le OH à l'équivalence, la réaction du cours étant OH- + H+ = H2O.
Pour mon exercice, j'ai juste écrit la réaction de dosage entre HNO3 et KOH qui me donne, sachant que K+ est un ion spectateur: NO3- + H2O = OH- + HNO3 et après je bloque...
l'énoncé de mon deuxième exercice:
Soient 100 mL d'une solution d'ammoniac NH3 10-1 mol L-1 que l'on dose par HCl 1 molL-1. Données : pour NH4+/NH3 pKa = 9,25
- Écrire la réaction de dosage
- Exprimer et calculer la constante d'équilibre
Aux différents points caractéristiques du dosage
- Faire le bilan des espèces majoritaires
- En déduire l'espèce / les espèces qui impose /imposent le pH
- Donner la formule de pH adaptée et faire l'application numérique
- Reporter les points dans un repère pH = f(x)
- Relier les points en respectant l'allure attendue pour le dosage d'un acide fort par une base forte
Calculer la précision du dosage et conclure.
Merci a ceux qui pourrons m'éclaircir...
Bonjour
Pour plus de lisibilité, il aurait été préférable de créer deux topics : un par exercice. Je commence par t'aider sur le premier.
Les ions nitrate et les ions potassium sont indifférent. La seule réaction susceptible de se produire est la réaction quasi totale :
H3O+ + HO- = 2H2O.
Il faut remplir trois tableaux d'avancement :
Le premier pour V<Ve : le réactif limitant est alors la soude ajoutée. Ce tableau te permettra d'avoir le cas particulier V=Ve/2.
Le deuxième concerne le cas particulier V=Ve : l'acide et la base sont mélangées en proportion stoechiométrique. Tu obtiens une solution de nitrate de potassium. Comme les ions nitrate et les ions potassium sont indifférents, le pH est celui de l'eau...
Le troisième concerne V>Ve : le réactif limitant est l'acide.
Pour t'aider un peu plus, voici la courbe pH = f(V) en bleu avec en plus les courbes représentant les variations en fonction de V de la concentration en ions oxonium (en rouge) et de la concentration en ions hydroxyde (en vert).
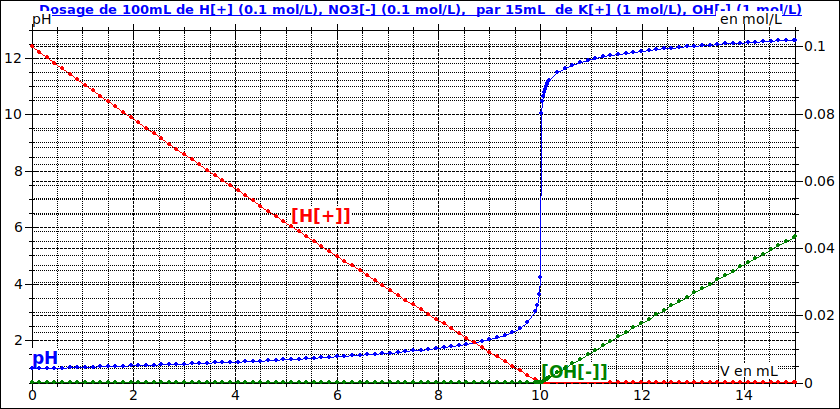
Ajouter de la soude ne peut que rendre la solution plus basique donc augmenter le pH. En plus : dans mon message précédent, Je t'ai fourni la courbe pH=f(V) ainsi que les courbes de concentrations !
Voici le tableau d'avancement valide avant l'équivalence.
| Espèces chimiques | H3O+ | HO- | H2O |
| Quantités introduites | Ca.Va | Cb.V | excès |
| Quantités à l'équilibre | Ca.Va-Cb.V |   0 0 | excès |
| Concentrations à l'équilibre |  ' ' 0 0 | excès |
A la demie équivalence :
Concentration à la demie équivalence :
Je te laisse terminer...