Inscription / Connexion Nouveau Sujet
dosage dichromate, baryum et soude
Bonsoir,
Je suis en train de faire un exercice. Comme je séchais je suis allée voir sur internet et j'ai trouvé la correction mais il y a certains points que je ne comprends pas dans cette denière. Voici l'énoncé de l'exercice :
On réalise un dosage en ajoutant à une solutions S de dichromate de potassium de volume E1=20,00mL et de concentration molaire 5,00.10-2mol.L-1 une solution S' de chlorure de baryum de concentration molaire 2,00.10-2mol.L-1 et de volume E2=50,00mL. On met le tout dans un bécher et on le dose par une solution d'hydroxyde de sodium étalonnée de concentration molaire 1,00.10-1mol.L-1.
Données :
- couple 1/2 Cr2072-/CrO42- associé à l'équation : 1/2 Cr2072- + 3/2 H20 = CrO42- + H30+
Ka=10-7,2
Produit de solubilité du chromate de baryum BaCrO4(s) : Ks=10-9,9
1. Ecrire l'équation de la réaction prépondérante des ions dichromate avec l'eau en présence d'ions baryum. Calculer sa constante d'équilibre. On considérera cette transformation comme quasi-totale dans la suite.
Dans la correction, il y a écrit directement 1/2 Cr2072- + 3/2 H20 + Ba2+ = BaCrO4(s) + H30+
Pour obtenir cette équation je pensais qu'il fallait tracer un axe de pKa et faire la méthode de la réaction prépondérante. Le problème est qu'on mélange deux notions : celle d'acide-base et celle de précipitation. Du coup, pour trouver ce résultat, est-ce qu'il faut se baser uniquement sur les données de l'énoncé ? Autrement dit, on prend toutes les espèces données dans la question et on essaye de trouver une réaction cohérente ?
En général, quand on mélange deux notions (par exemple précipitation et acide-base ou acide-base et complexation ect.) comment fait-on pour trouver la réaction prépondérante ?
Dans une des questions qui suit, on nous demande :
Ecrire les équations des réactions support du dosage rapportées à un équivalent de titrant en présence d'ions baryum.
Dans la réponse on a deux réactions de titrage : une faisant intervenir H30+ et l'autre faisant intervenir 1/2 Cr2072-. Pourquoi BaCrO4(s) ne peut pas intervenir dans une réaction de titrage ? Est-ce que c'est parce-qu'il est solide ?
Merci d'avance pour votre aide!
Bonsoir
C'est vrai qu'il n'y a pas de méthode générale aussi simple que la “règle du gamma” ou la comparaison des pKa. Il faut donc bien réfléchir en se laissant guider par l'énoncé. Ici la réduction des ions dichromate par l'eau est très limitée (Ka<<1) mais, dans la mesure où les ions chromate disparaissent, aussitôt leur formation, par réaction de précipitation, la réaction de réduction des ions dichromate peut être fortement déplacée dans le sens direct :
Bilan :
A l'équilibre, la constante d'équilibre de cette réaction s'écrit :
Pour la suite : calcule les quantités introduites des divers ions. Remplis éventuellement un tableau d'avancement. Tu constateras que, lorsque tous les ions baryum introduits ont réagit selon la réaction précédente quasi totale, 50% de la quantité introduite d'ion dichromate seulement a réagit selon cette réaction.
Tu vas donc obtenir deux sauts de pH correspondant à deux dosages successifs et indépendants :
1° : le dosage des ions oxonium produits par la réaction précédemment obtenue ; la réaction est de type dosage acide fort - base forte.
2° : le dosage des ions dichromate restants par la soude selon une réaction quasi totale.
Pour t'aider j'espère : voici une simulation de la courbe de titrage avec (échelle de droite) les évolutions des concentrations en ions dichromate et en ions chromate. Les faibles diminutions de concentrations observés s'expliquent par le phénomène de dilution. Seules les variations importantes de concentrations correspondent à des réactions chimiques.
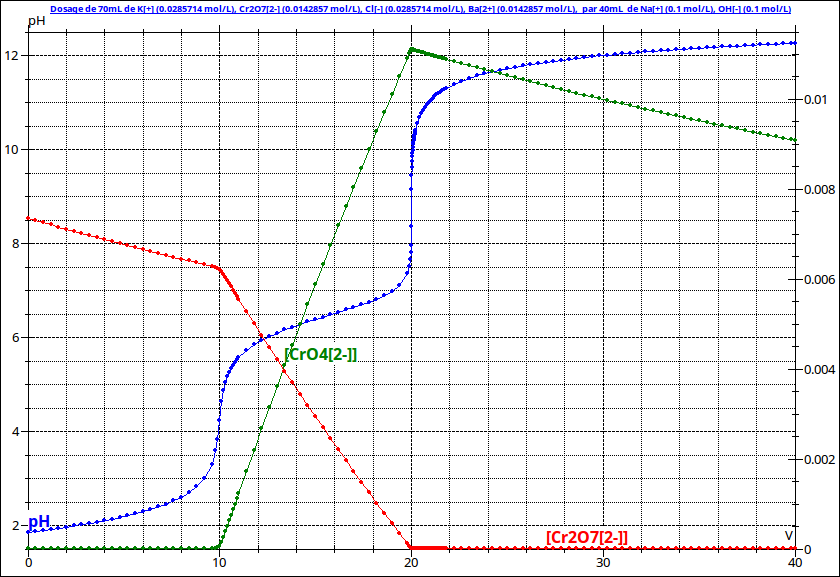
Merci 
Pour la 1ere question j'ai compris mais pour la 2e question, pourquoi n'y a-t'il pas de réaction de titrage associée à BaCrO4 ?
Merci 
Pour la 1ere question j'ai compris mais pour la 2e question, pourquoi n'y a-t'il pas de réaction de titrage associée à BaCrO4 ?
Bonsoir
Compte tenu de la réaction entre les ions baryum et les ions dichromate, avant que ne commence le dosage par la soude, la solution à doser contient :
1° : 1mmol de chromate de baryum :solide particulièrement stable (pKs=9,9) qui ne réagit ni avec les acides ni avec les bases et se dépose au fond du récipient sans intervenir lors du dosage par la soude ;
2° : 1mmol d'ions oxonium qui vont être dosés par 0,5mmol de soude donc par un volume de soude de 10mL selon une réaction de type acide-fort - base forte :
3° : 0,5mmol d'ions dichromate n'ayant pas réagit car les ions baryum constitue ici le réactif limitant. On peut considérer la réaction de titrage de ces ions dichromate comme une succession de deux réactions :
- celle des ions dichromate sur l'eau déjà écrite :
- celle des ions hydroxyde de la soude sur les ions oxonium fournis :
Bilan :
A l'équilibre :
K2>>1 : la réaction est quasi totale ; K2<<K : les réactions de dosage sont successives et indépendantes : on obtient deux sauts de pH un peu comme lors du dosage d'un mélange acide chlorhydrique - acide éthanoïque par de la soude.
Le titrage des 0,5mmol d'ions dichromate nécessite 1mmol d'ions hydroxyde soit aussi 10mL de solution de soude...
Cela est bien en accord avec les courbes fournies précédemment...


