Inscription / Connexion Nouveau Sujet
dosage de précipitation licence 2
bonjour,en cherchant une solution a cet exercice a propos de dosage pH-métrique de AL3+ par OH- voila l'exercice:
Al3+ + 3OH-?Al(OH)3 ks1=10^-32
Al(OH)3 + OH-?Al(OH)-4 ks=10^2
manipulation :
introduire Va=5ml de la solution diluéée de h2so4 dans un bécher muni d'un barreau aimenté et ajouter un volume Ve =30ml d'eau dustillée pour que les électrodes trempent suffisament .
ajouter V0=8 ml d'une solution ALCL3 C0=0.05mol/l.
efferctuer le dosage par NaoH C=0.1 MOL/L ( jusqu'un V=30ml) en traçant la courbe pH =f(v) sur une feuille de papier milimétrée.
Question :
1/donner les reactions du dosage et les expressions littérales et numériques de leur constantes de réaction .
2/calculer les valeurs des volumes équivalents attendus.
3/inteerpréter l'allure de la courbe du dosage .
4/ déterminer expérimentalement les valeurs de pks1 et pks2.
et ma question est que la concentration de [AL3+] =C0*V0/Vtotal ?.et Vtotale =30+30+5+8 ?ou bien [AL3+]=C0 ??
et comment interpréter l'allure de la courbe du dosage?
j'espere que quelqu'un va me répondre et merciiii.
Bonjour
Il serait beaucoup plus facile de t'aider efficacement si tu commences par expliquer ce que tu as fait et ce que tu ne comprends pas...
Peux-tu aussi scanner la courbe d'étalonnage et la poster ?
Pour la détermination de la concentration en ion aluminium initiale, il faut prendre en compte le volume total initial soit 43mL et non pas le volume total final comme tu le suggères ?
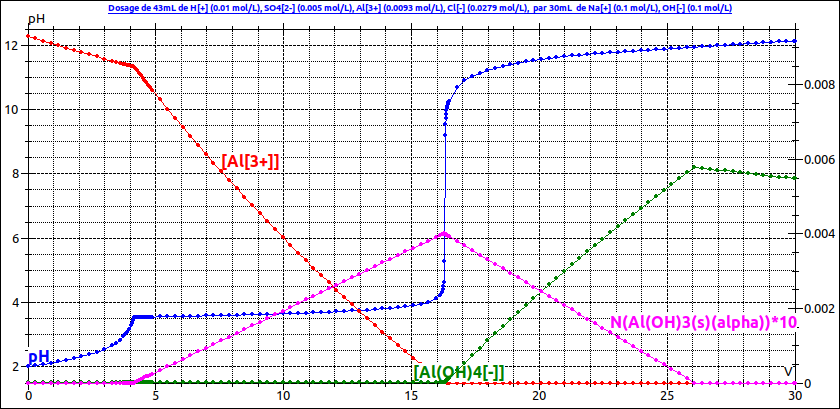
Pour t'aider un peu, voici une simulation concernant la courbe de titrage (en bleu). Pour bien comprendre, il faut surtout s'intéresser aux courbes d'évolutions des concentrations en ions Al3+ et Al(OH)4- ainsi qu'à la courbe d'évolution de la quantité de précipité Al(OH)3(s).
Puisque tu n'indiques pas la concentration en acide sulfurique initiale, je l'ai choisie arbitrairement de sorte que le pH initial soit voisin de 2. Une concentration différente conduit à des valeurs un peu différentes des volumes équivalents mais ne modifie pas l'allure de la courbe.
ah dcr .
j ai besoin de la concentration j ai calcuée comme ça [AL3+]=ks/[OH-]^3 = 10^-32/(10^-14)^3=1.10*10^10 mol/l.
pour faire l interprétation il faut que je trace le ph de AL3+ mais je sais pas comment ???? et pour les ph de AL(OH)3 et AL(OH-)4 on les trouves avec la manipulation dans laboratoire et on trace la courbe ph=f(v).
par example cette courbe donc jusqu'un au point anguleux c est l apparition de al(oh)3 aprés au point anguleux c'est la dissparition de al(oh)3 et eq1 jusqu'un eq2 l apparition de al(oh-)4 donc il me manque le trace de al3+??????
J'avais oublié de joindre la simulation dans mon message précédent. Toutes mes excuses ! Celle que tu fournis correspond à un autre exercice.
ah d 'accord merciiiiii beaucoup et une derniere question comment je vais tracer [al3+] genre comment calculer sont ph?
As-tu déjà eu l'occasion d'étudier et de comprendre des dosages par pHmétrie plus simples types acide fort par base forte ou acide faible par base forte ? Cela ne me semble pas certain compte tenu des questions que tu poses. Le dosage étudié ici est particulièrement délicat car le dosage acide sulfurique par base forte fait ensuite intervenir une précipitation suivie de la formation d'un complexe. Cela représente de nombreuses heures de cours qu'il n'est pas possible de résumer en quelques lignes sur un forum. Commence par bien étudier ton cours et essaye de répondre aux questions dans l'ordre où elles sont posées.


