Inscription / Connexion Nouveau Sujet
dosage de l'acide méthanoïque
Bonjour,
J'ai des questions sur un exercice qui parle du dosage par conductimétrie de l'acide méthanoïque dont voici l'énoncé :
On dose Va=100mL d'une solution HCO2H (pKa=3,8) Ca=0,01mol/L par NaOH Cb=0,10mol/L. Le dosage est suivi par conductimétrie en mesurant la conductance G en fonction du volume Vb de soude versé
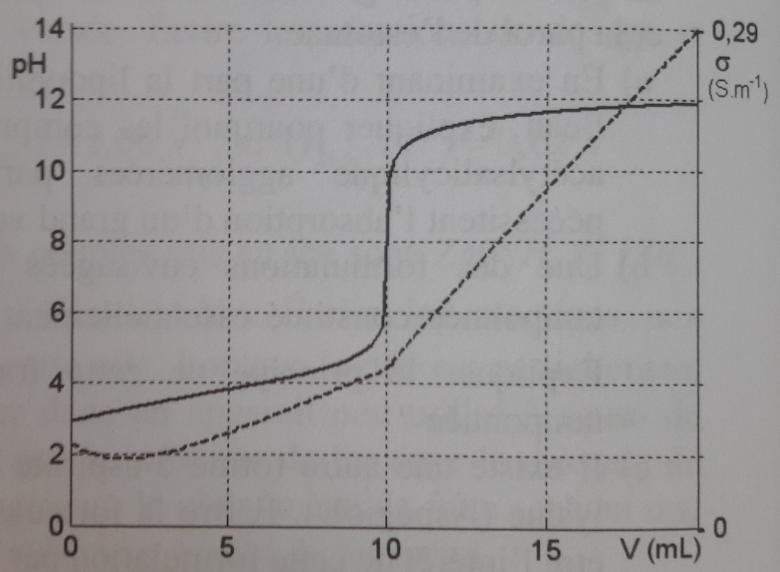
1) Indiquer l'allure de la courbe de dosage attendue. A quelle condition un tel tracé conduit à des segments de droites ? En réalité, on obtient la courbe ci-contre. Commenter.
| NH4+ | Na+ | HCO2- | HO- | H3O+ | |
 °(mS.m².mol-1 °(mS.m².mol-1 | 7 | 5 | 4 | 20 | 35 |
Je pensais qu'on avait une droite négative de V=0 à V=Ve puisque, pour V<Ve, on a la RP : HCO2H+HO-=HCO2-+H2O et, comme la conductivité de HCO2- formés est inférieure à celle des HO- formés, la conductivité diminue.
Puis, pour V>Ve, on a : H2O + HO-= H2O + HO- donc la conductivité est constante.
Mais quand on regarde la courbe donnée ensuite, cela ne correspond pas du tout à ce que j'ai trouvé. Je pense que mon raisonnement est faux mais je ne vois pas en quoi.
Ensuite, il y a écrit dans la correction que la coube conductimétrique n'est pas représentée par une droite entre V=0 et Ve à cause de la réaction H3O+ + HO- = 2H2O qui se produit aussi.
Je ne comprends pas pourquoi on a cette réaction. Pourquoi est-ce qu'on a des H3O+?
Merci d'avance pour vos explications !
Bonjour
La conductimétrie est sans doute le seul exemple où il est nécessaire d'écrire l'équation bilan en tenant compte des ions spectateurs (indifférents). Je pense que ton incompréhension de l'allure de la courbe s'explique par la non prise en compte des ions sodium.
Avant équivalence :
HCOOH + Na+ + HO- = Na+ + HCOO-+H2O
A chaque fois que tu ajoutes en solution un ion sodium et un ion hydroxyde, reste en solution après réaction un ion sodium et un ion éthanoate. La conductivité augmente donc.
Après équivalence :
A chaque fois que tu ajoutes en solution un ion sodium et un ion hydroxyde, ces deux ions restent en solution. Par rapport à la situation précédente, le même ajout prduit en solution un ion sodium et un ion hydroxyde au lieu de produire un ion sodium et un ion éthanoate. Comme la conductivité molaire de l'ion hydroxyde est nettement supérieure à cette de l'ion éthanoate, le passage à l'équivalence correspond à une forte augmentation du coefficient directeur de la droite  =f(V)
=f(V)
Cas particulier : 0<V<2,5mL (environ)
Tu sais bien que l'acide éthanoïque en solution aqueuse réagit sur l'eau de façon très partielle selon la réaction :
HCOOH + H2O = H3O+ + HCOO-
La soude ajoutée commence donc par neutraliser ces ions oxonium avant de réagir sur l'acide méthanoïque. Dans ce cas, l'ajout d'un ion sodium et d'un ion hydroxyde se traduit par l'apparition en solution d'un ion sodium et par la disparition d'un ion oxonium. Comme la conductivité molaire de l'ion oxonium est nettement supérieure à celle de l'ion sodium, on observe une baisse de conductivité de la solution.
J'ai eu l'occasion il y a quelque temps d'étudier ce type de dosage et d'écrire les équations correspondant au pH et à la conductivité. Peut-être que cela n'est pas à ton programme. Voici tout de même la référence au cas où...
![]()
Je crois que c'est un peu plus clair, je vais essayer de m'entraîner avec le dosage qui est dans ta fiche pour vérifier si j'ai bien compris


