Inscription / Connexion Nouveau Sujet
Dosage Conductimétrique
Bonsoir à tous, j'aurais besoin d'aide pour un exercice, merci d'avance pour vote aide 
Voici le sujet :
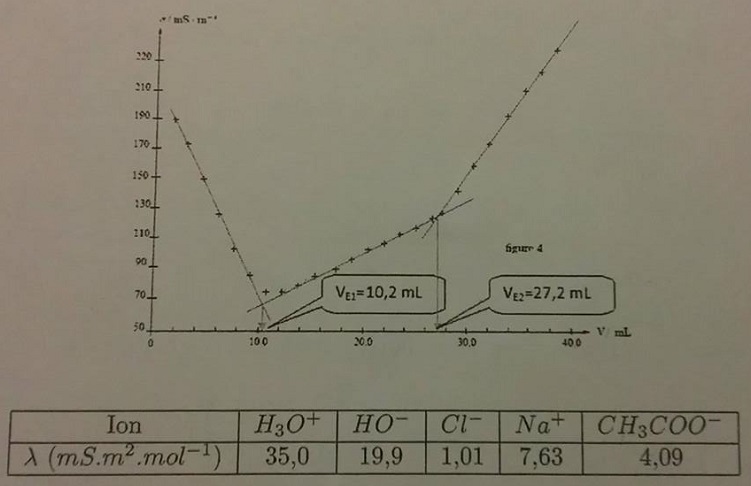
On dose le mélange d'acide chlorhydrique de concentration C1 et d'acide éthanoïque de concentration C2 par une solution de soude à CB = 0, 100 mol / L. On prélève V0 = 25, 0 mL du mélange et on ajoute V1 0 =175, 0 mL d'eau distillée dans un bécher de 250 mL. La conductivité de la solution en fonction du volume de titrant est représentée sur la courbe de la figure.
1) Pourquoi ajoute-t-on de l'eau distillée ? (J'ai répondu car c'est un milieu infiniment dilué )
2)En appuyant sur les conductivités molaires ioniques, expliquez l'allure de la courbe de titrage. ( La réaction d'autoprotolyse de l'eau sera négligée ) ? ( je n'y arrive pas )
3) Calculer les concentrations en acide chlorhydrique et éthanoïque ? ( Je n'y arrive pas )
4) Ecrire l'équation dissociation du chlorure d'hydrogène pour former la solution d'acide chlorhydrique. ( Je n'y arrive pas )
5) Calculer la concentration initiale en ions hydronium (H3O+) dans le bécher. Attention à l'ajout d'eau distillée. ( Je n'y arrive pas )
6) Exprimer puis calculer ( en vous aidant des questions 4 et 5 ) la valeur de la conductivité initiale de la solution ( Je ne peux donc pas traiter cette question )
Pour les questions 7) 8) 9) 10) je ne vous embête pas avec étant donné que j'ai réussi à les traiter.
Encore merci de votre aide et de votre patience
Bonsoir,
Pourquoi ajoute-t-on de l'eau distillée ? (J'ai répondu car c'est un milieu infiniment dilué )
"infiniment" est un peu trop fort. Disons seulement que la loi que tu connais exprimant la conductivité en fonction des concentrations est d'autant mieux respectée que les concentrations sont faibles. Il y a une autre raison : si le volume initial est très grand devant le volume de solution de soude ajouté, on peut considérer le volume total comme pratiquement fixe : les courbes successives correspondant aux variations de conductivité en fonction du volume ajouté sont assimilables à des segments de droite, ce qui rend plus précise la détermination des volumes équivalents. Dans le cas général, on obtient des branches d'hyperboles...
Pour la suite, commence par faire l'inventaire des couples acide/base susceptibles d'intervenir. Tu dois montrer qu'il y a deux réactions de titrage quasi totales, successives et indépendantes. Écris les équations bilan en tenant compte, une fois n'est pas coutume des ions spectateurs (ions indifférents). En faisant le bilan, dans chaque cas, des ions qui apparaissent et des ions qui disparaissent, tu devrais facilement justifier l'allure des courbes.
Bonjour,
Quelques précisions supplémentaires.
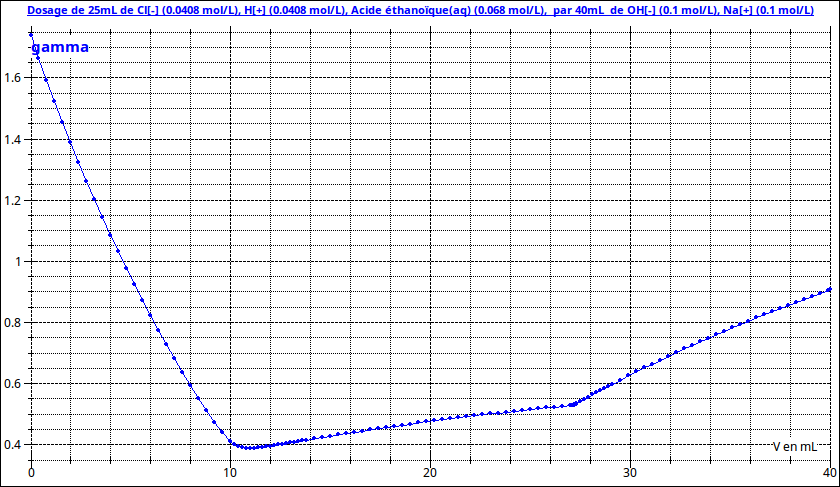
Pour illustrer mon propos sur l'intérêt de l'ajout d'un volume important d'eau distillée, j'ai simulé sur le premier document la courbe représentant les variations de conductivité en fonction du volume de soude ajouté sans l'ajout d'eau distillée mais avec les mêmes quantités d'acide. Les volumes équivalents sont les mêmes mais leur détermination graphique sera beaucoup moins précise puisque la courbe n'est plus assimilable à une succession de segments de droites ; n'oublie pas qu'en TP, tu as beaucoup moins de points expérimentaux qu'ils n'y a de points simulés par le logiciel !
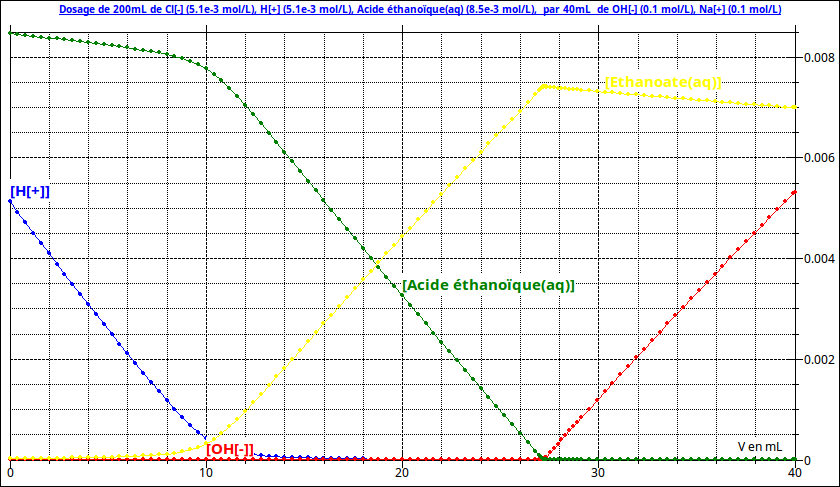
La seconde courbe pourra peut-être t'aider à comprendre ce qui se passe au cours du dosage. Dans le cas du dosage avec eau distillée ajoutée, le logiciel représente les évolutions au cours du dosage des différentes concentrations : observe bien comment évolue chaque concentration dans les trois cas :
V < VE1
VE1 < V < VE2
V > VE2
P.S. : les titres des courbes pourront t'aider à valider tes calculs de concentrations...
Bonjour en faites le problème c'est que je n'ai pas d'exemple je ne sais pas comment faire c'est un exo mais je voudrais quand même que quelqu'un maide à faire les questions pour que ji arrive à le refaire
Je t'aide pour le cas V < VE1 ; tu continueras.
La première réaction est la réaction avec l'acide le plus fort : l'acide chlorhydrique. Cette réaction peut être considérée comme totale car sa constante d'équilibre (1014) est très suprieure à un. L'équation bilan est :
H3O+ + Cl - + Na+ + HO- ==> 2H2O + Na+ + Cl-
A chaque fois que tu ajoute un ion Na+ et un ion HO- , il y a apparition dans le mélange d'un ion Na+ et disparition d'un ion H3O+ ; comme la conductivité molaire équivalente de H3O+ est nettement plus élevée que celle de Na+ : la conductivité de la solution diminue fortement. Cette diminution s'arrête à la première équivalence, c'est à dire lorsque la quantité de HO- ajouté : CB.VE1 est égale à la quantité initiale de H30+ : C1.Vo.
Bonjour Vanoise, ayant à peu près le même type d'exercice à effectuer, je trouve que celui-ci peut faire un bon exemple pour m'aider à comprendre la conductimétrie. Malheureusement j'ai beaucoup de mal à vous suivre, à quels question répondez vous ? Y a t'il moyen que vous m'expliquer plus simplement s'il vous plait ? Car j'ai vraiment du mal à comprendre.
Je vous pris de m'excuser et vous remercie d'avance
Pour la question 1) ma réponse est :
il y a plusieurs raison à l'ajout d'eau distillée:
- la première est purement pratique, il faut que le cellule de conductimétrie soit immergée
- la deuxième permet de faciliter l'exploitation : la conductivité varie avec la concentration.
Est-ce bon ?
Et pour ce qui est de la question 2 je propose de faire un tableau "avant l'équation" "après équation" et d'en conclure les résultats
Je ne cherche surtout pas à faire un corrigé "type" ; je donne juste des pistes de réflexion... Évidemment, je suppose connus les résultats essentiels du cours de chimie sur la conductimétrie et sur les dosages acido-basique.
pour la 2:
j'ai trouver les équation suivante:
HCl + H2O=H3O++cl-
CH3COOH+H2O=CH3COO-+H3O+
 TOTAL=35+1,01=36,01
TOTAL=35+1,01=36,01
 total=35+4,09=39,09
total=35+4,09=39,09
La question 2 demande d'expliquer pourquoi la conductivité décroît fortement en fonction de V pour V<VE1, pourquoi elle augmentefaiblement en fonction de V pour VE1<V<VE2 et pourquoi elle augmente fortement en fonction de V pour V > VE2.
J'ai donné la méthode générale dans mon premier message et j'ai répondu au premier tiers de cette question dans mon message posté à 14h13...
Je me répète : il est illusoire d'espérer réussir ce type d'exercice sans de bonnes connaissances de cours sur les équilibres acido-basiques, sur les titrages acide - base et sur la conductimétrie. Revois donc d'abord ton cours de façon approfondie


