Inscription / Connexion Nouveau Sujet
Diagramme E-pL
Bonjour
Je dois établir les équations des portions de droites (1) (2) (3)
Mais je n'y parviens pas ...
J'ai écrit les équations mais en remplaçant dans la relation de Nerst j'obtiens toujours la même équation.
(1)
(2)
(3)
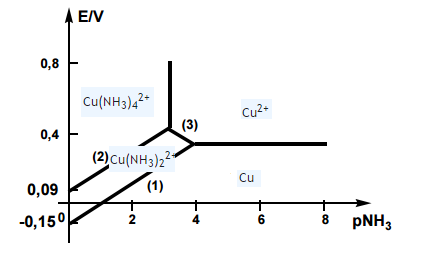
Tu obtiens effectivement toujours la même formule de Nernst mais, suivant la frontière que tu étudie, [Cu2+] obéit à des lois différentes, suivant qu'il est en équilibre avec le cuivre solide, ou avec l'un ou l'autre des complexes
J'allais oublier : il s'agit d'un diagramme potentiel -pH (ou diagramme de Pourbaix, du nom de son inventeur belge), pas d'un diagramme E-pL parfois utilisé dans l'étude des complexes.
[Cu2+] obéit à des lois différentes, suivant qu'il est en équilibre avec le cuivre solide, ou avec l'un ou l'autre des complexes
C'est là qu'est tout le problème les différentes lois auxquelles [Cu2+] obéit, pour moi [Cu2+] n'a de relation avec les autres espèces que dans sur la portion de droite (3) où il se produit la réaction suivante :
(3)
ceci donne
J'allais oublier : il s'agit d'un diagramme potentiel -pH (ou diagramme de Pourbaix, du nom de son inventeur belge), pas d'un diagramme E-pL parfois utilisé dans l'étude des complexes.
Non justement regarde l'abscisse il s'agit bien du pL, c'est justement là qu'on est dans l'étude des complexes avec NH3 le ligand
toujours bloqué

Tu as raison : ce n'est pas un diagramme de Pourbaix mais bien un diagramme potentiel -pL puisqu'ici l'ammoniac se comporte en ligand. Il y a plusieurs conventions de tracés possibles. La plus fréquente est la suivante :
sur une ligne frontière entre deux espèces dissoutes, les concentrations de ces deux espèces dissoutes sont égales entre elles ;
sur une frontière entre un solide et une espèce dissoute, on considère que le solide existe (son activité vaut 1) mais en quantité négligeable.
dans tous les cours que j'ai, on part de la formule de Nerst pour obtenir les équations des droites
que ce soit E-pH ou E-pL, donc comment expliquer que
et ce n'est pas en cohérence avec la pente négative observée en (3) sur le diagramme ...
Je pense avoir trouvé pourquoi tu n'y arrives pas : le complexe dont le domaine est délimité par les frontières 1,2 et 3 est l'ion diammine cuivre(I) Cu(NH3)2+ et non l'ion diamminecuivre(II) Cu(NH3)22+ comme indiqué sur ton schéma. Le complexe stable correspondant au degré d'oxydation +II du cuivre est l'ion tétramminecuivre(II) dont le domaine de prédominance est au-dessus de la frontière 2